Đề thi thử Đại học 2025 môn Hóa học – Sở GD Bình Phước là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT
Đề thi bám sát cấu trúc đề minh họa 2025 của Bộ GD&ĐT, tập trung vào các chuyên đề trọng tâm như: este – lipit, amino axit – protein, polime, kim loại, phản ứng hóa học và các dạng bài bảo toàn – nhận biết. Đây là tài liệu hữu ích giúp học sinh luyện tập toàn diện, nâng cao khả năng tư duy và rèn kỹ năng giải nhanh trắc nghiệm Hóa học.
Hãy cùng Dethitracnghiem.vn thử sức với đề thi này để sẵn sàng cho kỳ thi tốt nghiệp THPT 2025!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GD BÌNH PHƯỚC



PHẦN I. Trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Nhỏ vàI giọt dung dịch iođua vào dung dịch nào sau đây thì thấy xuất hiện màu xanh tím?
A. Glucose.
B. Saccharose.
C. Hồ tinh bột.
D. Lòng trắng trứng.
Câu 2: Phản ứng chlorine hóa methane khi chiếu sáng xảy ra theo cơ chế gốc gồm ba giai đoạn: khơi mào, phát triển mạch và tắt mạch. Trong đó, giai đoạn phát triển mạch diễn ra như sau:
Cl₂ + CH₄ → HCl + CH₃•
CH₃• + Cl₂ → CH₃Cl + Cl•
Nhận định nào sau đây không đúng về giai đoạn này?
A. Có sự hình thành liên kết H-Cl.
C. Có sự hình thành liên kết H-C.
B. Có sự phân cắt liên kết C-H.
D. Có sự hình thành liên kết π.
Câu 3: Một học sinh thiết lập một pin điện hóa gồm hai mảnh kẽm (Zn) và đồng (Cu) cắm vào một quả chanh và sau đó nối với đầu bên ngoài một ampe kế, thấy kim chỉ lệch khỏi vạch 0 (hình vẽ). Quá trình nào có thể xảy ra tại điện cực kẽm?
A. Khử H⁺ thành H₂.
B. Khử Cu²⁺ thành Cu.
C. Khử Zn²⁺ thành Zn.
D. Oxi hóa Zn thành Zn²⁺.
Câu 4: Cho các polymer sau: PE, PVC, cao su buna, poly(methyl methacrylate), tơ tằm, tơ nylon-6,6. Số polymer được điều chế bằng phản ứng trùng hợp là
A. 2.
B. 3.
C. 5.
D. 4.
Câu 5: Thủy phân hoàn toàn cellulose trong môi trường acid, thu được chất nào sau đây?
A. Glycerol.
B. Glucose.
C. Ethyl alcohol.
D. Saccharose.
Câu 6: Chất nào sau đây là amino acid?
A. H₂NCH₂COOH.
B. H₂NCH₂CH₂COOH.
C. CH₃NHCH₂CH₃.
D. HOCH₂COOHNH₄.
Câu 7: Ăn mòn kim loại là hiện tượng phổ biến trong đời sống hàng ngày. Phương pháp nào sau đây có thể giúp phần nào hạn chế sự ăn mòn kim loại?
A. Cuộn dây đồng vào van sắt của bể nước mặt của vật dụng kim loại.
B. Phủ một lớp sơn hoặc lớp dầu lên bề mặt kim loại đối với những khoáng thời gian nhất định.
C. Sử dụng giấy ráp đánh sạch bề mặt kim loại sau mỗi lần kim loại “vật dụng kim loại”.
D. Dùng nước muối ăn để diệt các vi khuẩn bám trên bề mặt hay còn gọi là “vi nhiễm trùng” gây ảnh hưởng.
Câu 8: Chất thải nhựa và túi nylon (PE, PVC,…) hay còn gọi là các “chất thải nhựa” gây ảnh hưởng nghiêm trọng đến môi trường. Phương pháp nào sau đây không giúp giảm thiểu tác động của rác thải nhựa đến môi trường?
A. Thay thế túi nylon bằng túi giấy, túi vải tái sử dụng nhiều lần.
B. Tiêu hủy các chất thải nhựa và túi nylon bằng phương pháp đốt hoặc chôn lấp.
C. Phân loại rác thải nhựa từ đầu nguồn để tái chế.
D. Tái sử dụng đồ nhựa, chai nhựa làm đồ dùng.
Câu 9: Trong thí nghiệm xác định hàm lượng muối Fe(II) bằng dung dịch thuốc tím, nhận xét nào sau đây là không đúng?
A. Ion Fe²⁺ là chất bị oxi hóa.
B. Ion MnO₄⁻ là chất bị khử.
C. Dung dịch muối Fe(II) có màu vàng nhạt.
D. H₂SO₄ là chất tạo môi trường phản ứng.
Câu 10: Carbohydrate nào sau đây có nhiều trong quả nho chín?
A. Fructose.
B. Saccharose.
C. Cellulose.
D. Glucose.
Câu 11: Xử lí chất thải trong chăn nuôi gia súc bằng hầm biogas hoặc túi biogas vừa giảm ô nhiễm môi trường vừa giúp tiết kiệm nhiên liệu. Phương pháp này tiết kiệm nhiên liệu vì khí biogas
A. chứa nhiều C₂H₅OH, dễ cháy tỏa nhiều nhiệt.
B. chứa nhiều CH₄, vì khí biogas khi đốt cháy.
C. chứa nhiều CH₄, dễ cháy tỏa nhiều nhiệt.
D. chứa nhiều CH₄, không độc hại với môi trường.
Câu 12: Acid béo omega-3 và omega-6 đều có vai trò quan trọng đối với cơ thể, giúp phòng ngừa nhiều loại bệnh. Chất nào sau đây Không thuộc loại acid béo omega-6?
A.![]()
B.![]()
C.![]()
D.![]()
Câu 13: Một số cơ sở sản xuất dùng formol để giúp các sản phẩm như bún, bánh phở, mì,… lâu bị mốc hỏng vì formol có tính năng diệt khuẩn mạnh. Tuy nhiên formol rất độc hại với sức khỏe con người (gây ung thư), thuộc danh mục hóa chất bị cấm sử dụng trong thực phẩm. Formol là dung dịch của chất nào sau đây?
A. Acetone.
B. Phenol.
C. Formaldehyde.
D. Methanol.
Câu 14: Khi nói về liên kết kim loại: “Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron…(1)… với các ion…(2)… kim loại ở các nút mạng. Các từ cần điền vào vị trí (1), (2) để được phát biểu đúng là
A. ngoài cùng, dương
B. hóa trị, âm.
C. hóa trị, dương.
D. tự do, dương.
Câu 15: Một người thợ sơn lựa chọn một dung môi để bay hơi và có độ phân cực kém pha vào sơn giúp sơn nhanh khô khi sử dụng. Chất nào sau đây phù hợp
A. Acetic acid.
B. Isoamyl acetate.
C. Glucose.
D. Nước.
Câu 16: Sodium hydrogencarbonate là chất được dùng làm bột nở, chế thuốc hỗ trợ điều trị triệu chứng đau dạ dày do thừa axit. Công thức của sodium hydrogencarbonate là
A. NaHS.
B. NaH₂CO₃.
C. NaHCO₃.
D. NaOH.
Câu 17: Cho biết thế điện cực chuẩn của các cặp oxi hóa-khử Zn²⁺/Zn, Ag⁺/Ag lần lượt là -0,76 V và 0,8 V. Sức điện động chuẩn của pin có giá trị bằng
A. -1,56.
B. 0,34.
C. 0,42.
D. 1,10.
Câu 18: Kết quả trình bày điện phân dung dịch NaCl bão hòa có màng ngăn. Phát biểu nào sau đây đúng?
A. Quá trình xảy ra tại cathode là Na⁺ + 1e → Na.
B. Dung dịch thu được sau điện phân có chứa NaClO.
C. Quá trình xảy ra tại anode là 2H₂O + 2e → H₂ + 2OH⁻.
D. Dung dịch thu được sau phản ứng là dung dịch NaOH.
PHẦN II. Tự luận. Thí sinh trả lời từ câu 1 đến câu 6. Mỗi câu, thí sinh chọn đúng hoặc sai.
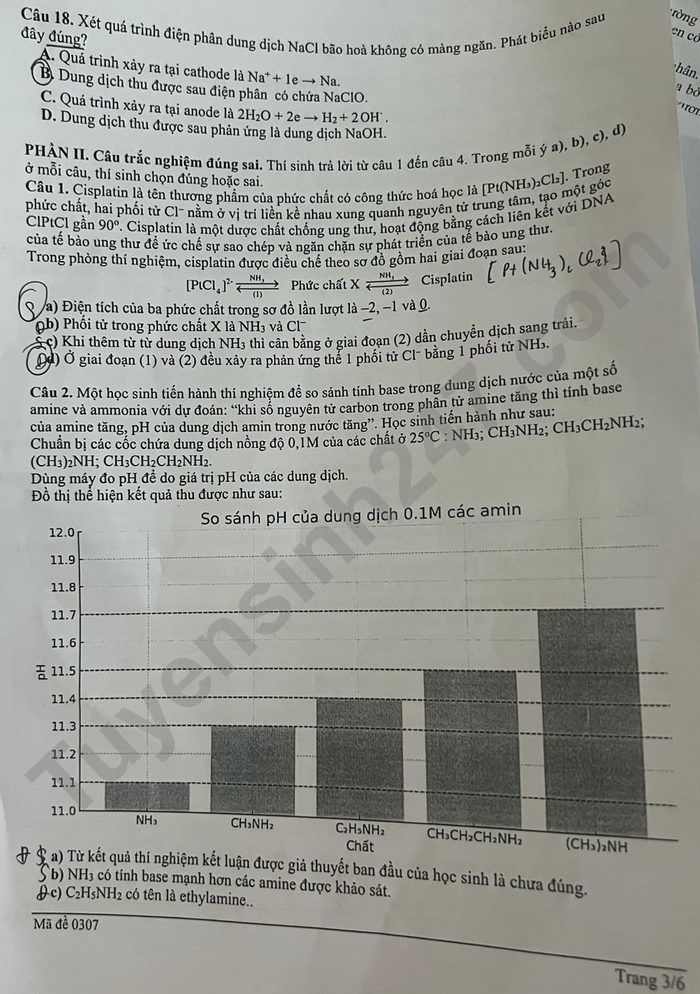
Câu 1. Cisplatin là tên thương phẩm của phức chất có công thức hoá học là [Pt(NH₃)₂Cl₂]. Trong phức chất, hai phối tử Cl⁻ nằm ở vị trí liên kết nhau quang nguyên tử trung tâm, tạo một góc ClPtCl gần 90°. Cisplatin là một trong những hoá chất chống ung thư quan trọng bằng cách liên kết với DNA của tế bào ung thư để ức chế sự sao chép và ngăn chặn sự phát triển của tế bào ung thư.
Trong phòng thí nghiệm, cisplatin được điều chế theo sơ đồ gồm hai giai đoạn sau:
[PtCl₄]²⁻ –(1)–> X –(2)–> Cisplatin [Pt(NH₃)₂Cl₂]
a) (0,5 điểm) Dựa vào diện tích của ba phức chất trong sơ đồ trên lần lượt là −2, −1 và 0.
b) (0,5 điểm) Phối tử trong phức chất X là NH₃ và Cl⁻.
c) (1,0 điểm) Khi thêm từ từ dung dịch NH₃ chỉ cần bằng ở giai đoạn (2) dẫn chuyển dịch sang trái.
d) (0,5 điểm) Ở giai đoạn (1) và (2) đều xảy ra phản ứng thế 1 phối tử Cl⁻ bằng 1 phối tử NH₃.
Câu 2. Một học sinh tiến hành thí nghiệm để so sánh tính base trong dung dịch nước của một số amine và ammonia với dự đoán: “khi số nguyên tử carbon trong phân tử amine tăng thì tính base của amine tăng, pH của dung dịch amin trong nước tăng”. Học sinh tiến hành như sau:
Chuẩn bị các chửa dung dịch nồng độ 0,1M của các chất ở 25°C: NH₃; CH₃NH₂; CH₃CH₂NH₂; (CH₃)₂NH; CH₃CH₂CH₂NH₂; (CH₃)₃N.
Dùng máy đo pH để đo giá trị pH của các dung dịch.
Đồ thị thể hiện kết quả thu được như sau:
So sánh pH của dung dịch 0,1M các amin
(Đồ thị cột biểu diễn pH của các dung dịch 0,1M của NH₃, CH₃NH₂, CH₃CH₂NH₂, CH₃CH₂CH₂NH₂, (CH₃)₂NH. pH tăng dần từ NH₃ đến (CH₃)₂NH)
a) (1,0 điểm) Từ kết quả thí nghiệm kết luận được giả thuyết ban đầu của học sinh là chưa đúng.
b) (0,5 điểm) NH₃ có tính base mạnh hơn các amine khác sau.
c) (0,5 điểm) C₂H₅NH₂ có tên là ethylamine.
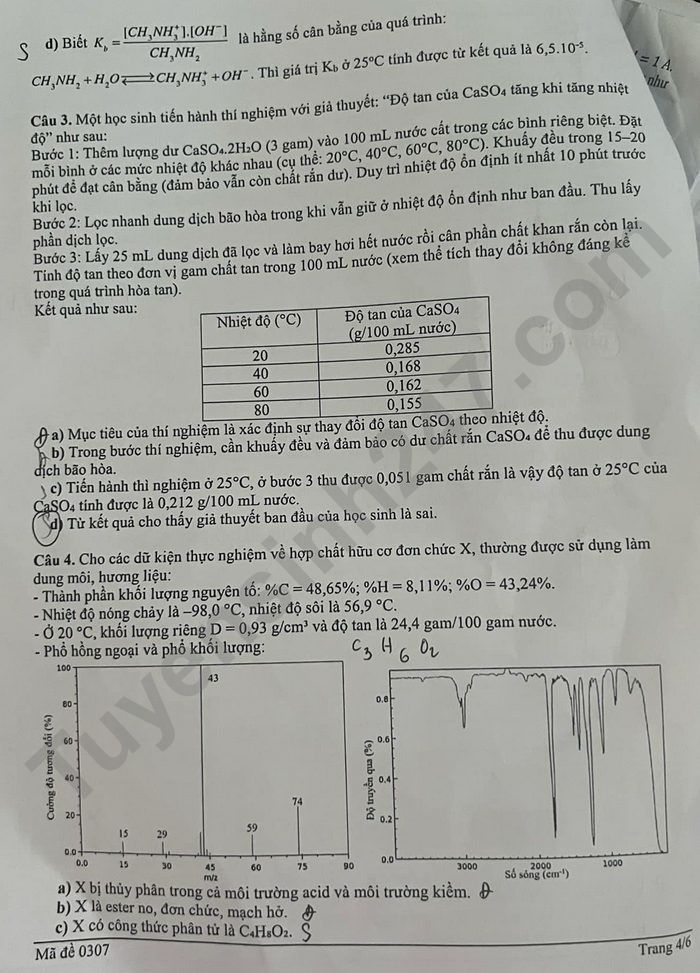
d) (0,5 điểm) Biết K_b của [CH₃NH₃][OH⁻]/[CH₃NH₂] là hằng số cân bằng của quá trình: CH₃NH₂ + H₂O ⇌ CH₃NH₃⁺ + OH⁻. Thí giá trị K_b ở 25°C tính được từ kết quả là 6,5.10⁻⁴.
Câu 3. Một học sinh tiến hành thí nghiệm với giả thuyết: “Độ tan của CaSO₄ tăng khi tăng nhiệt độ” như sau:
Bước 1: Thêm lượng dư CaSO₄.2H₂O (3 gam) vào 100 mL nước cất trong các bình riêng biệt. Đặt mỗi bình ở các mức nhiệt độ khác nhau (cụ thể: 20°C, 40°C, 60°C, 80°C). Khuấy đều trong 15-20 phút để đạt cân bằng (đảm bảo vẫn còn chất rắn dư). Duy trì nhiệt độ ổn định ít nhất 10 phút trước khi lọc.
Bước 2: Lọc nhanh dung dịch bão hòa trong khi vẫn giữ ở nhiệt độ ổn định như ban đầu. Thu lấy phần dịch lọc.
Bước 3: Lấy 25 mL dung dịch đã lọc và làm bay hơi hết nước rồi cân phần chất rắn khan còn lại. Tính độ tan theo đơn vị gam chất tan trong 100 mL nước (xem thể tích thay đổi không đáng kể trong quá trình hòa tan).
Kết quả như sau:
Nhiệt độ (°C) Độ tan của CaSO₄ ( g/100 mL nước)
20 0,285
40 0,168
60 0,105
80 0,055
a) (1,0 điểm) Mục tiêu của thí nghiệm là xác định sự thay đổi độ tan CaSO₄ theo nhiệt độ.
b) (0,5 điểm) Trong bước thí nghiệm, cần khuấy đều và đảm bảo có dư chất rắn CaSO₄ để thu được dung dịch bão hòa.
c) (0,5 điểm) Tiển hành thí nghiệm ở 25°C, ở bước 3 thu được 0,051 gam chất rắn là vậy độ tan ở 25°C của CaSO₄ tính được là 0,212 g/100 mL nước.
d) (0,5 điểm) Từ kết quả cho thấy giả thuyết ban đầu của học sinh là sai.
Câu 4. Cho các dữ kiện thực nghiệm về hợp chất hữu cơ đơn chức X, thường được sử dụng làm dung môi, hương liệu:
Thành phần khối lượng nguyên tố: %C = 48,65%; %H = 8,11%; %O = 43,24%.
Nhiệt độ nóng chảy là −98,0°C, nhiệt độ sôi là 56,9°C.
Ở 20°C, khối lượng riêng D = 0,93 g/cm³ và độ tan là 24,4 gam/100 gam nước.
Phổ hồng ngoại và phổ khối lượng:
(Phổ khối lượng có các pic tại m/z 15, 29, 43, 59, 74)
(Phổ hồng ngoại có các mũi hấp thụ quan trọng)
a) (1,0 điểm) X bị thủy phân trong cả môi trường acid và môi trường kiềm.
b) (0,5 điểm) X là ester no, đơn chức, mạch hở.
c) (0,5 điểm) X có công thức phân tử là C₃H₆O₂.
d) (0,5 điểm) Ở 20°C, dung dịch X bão hòa có nồng độ phần trăm là 19,6%.
Câu 5. Ester X có công thức phân tử là C₅H₁₀O₂. X phản ứng với dung dịch NaOH khi đun nóng tạo muối sodium formate. Có bao nhiêu đồng phân cấu tạo phù hợp với X?
Câu 6. Cellulose là một loại carbohydrate phổ biến trong thực vật, bị thủy phân thành glucose nhưng cellulose không được sử dụng dinh dưỡng cho cơ thể.
(1) Glycogen là carbohydrate được lưu trữ trong gan và cơ bắp giúp cung cấp năng lượng nhanh chóng cho cơ khi cần.
(2) Quá trình tổng hợp glucose và tinh bột trong cây xanh giúp tăng lượng khí gây hiệu ứng nhà kính.
(3) Nước tiểu của người bệnh tiểu đường (đái tháo đường) chứa hàm lượng đường cao, chủ yếu là fructose.
Hãy sắp xếp các phát biểu đúng theo thứ tự từ nhỏ đến lớn tần suất (ví dụ: 12, 134,…).
Câu 7. Hai chất MnO₂ và Fe₂O₃ đều có khả năng xúc tác cho phản ứng phân hủy H₂O₂. Độ nồng độ H₂O₂ theo thời gian, được đồ thị sau:
(Đồ thị nồng độ H₂O₂ theo thời gian với hai đường cong, một nhanh hơn (xúc tác Fe₂O₃), một chậm hơn (xúc tác MnO₂))
(1) Khi dùng xúc tác MnO₂ và Fe₂O₃ đều có thể làm tăng hoặc làm giảm tốc độ phản ứng.
(2) Trong quá trình phản ứng nồng độ của H₂O₂ tăng.
(3) Xúc tác MnO₂ có hiệu quả hơn với thí nồng độ H₂O₂ theo thời gian khi có mặt MnO₂ hoặc khi có Fe₂O₃.
(4) Sau phản ứng khối lượng MnO₂ và Fe₂O₃ tăng.
Hãy sắp xếp các phát biểu không đúng theo thứ tự tần suất (ví dụ: 12, 134,…).
Câu 8. Theo Quy chuẩn Việt Nam về nước sinh hoạt (QCVN 01-1:2018/BYT), tổng nồng độ ion sắt (tổng sắt) trong nước uống: ≤ 0,3 mg/L. Nước suối ở những vùng nằm trên nền địa chất có nhiều quặng sắt thường có nồng độ ion sắt rất cao. Chuẩn bị 50 mL một mẫu nước suối (ở Tây Ban Nha), bằng dung dịch KMnO₄ 0,01M trong môi trường H₂SO₄ đến khi dung dịch chuyển sang màu hồng (bền trong 20 giây) thì thể tích dung dịch KMnO₄ đã dùng là 4 mL. Hỏi nồng độ Fe²⁺ (mg/L) trong nước suối này vượt gấp bao nhiêu lần so với tổng nồng độ ion sắt tối đa cho phép đối với nước uống theo quy chuẩn của Bộ Y tế Việt Nam? (Làm tròn số đến hàng đơn vị)
Câu 9. Để xác định hàm lượng vàng nóng (là hợp kim của Au, Cu) người ta tiến hành cân chính xác một mẫu vàng nóng m₁ gam, sau đó ngâm mẫu này trong lượng dư dung dịch X đến khi khối lượng chất rắn không thay đổi, lọc lấy phần rắn, rửa sạch làm khô, cân lại được m₂ gam và hàm lượng vàng như sau: %Au = m₂/m₁ * 100%.
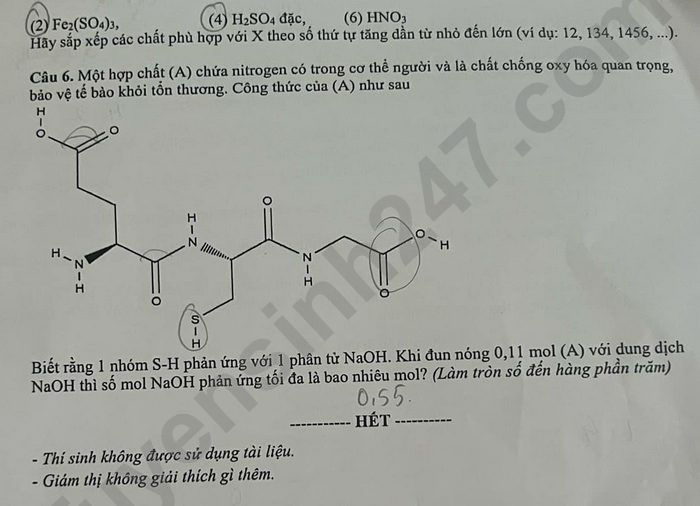
Cho chất: (1) AuCl₃, (2) Fe₂(SO₄)₃, (3) AgNO₃, (4) H₂SO₄ đặc, (5) Cu(NO₃)₂ (6) HNO₃
Hãy sắp xếp các chất phù hợp với X theo thứ tự tăng dần từ nhỏ đến lớn (ví dụ: 12, 134, 1456, …).
Câu 10. Một hợp chất (A) chứa nitrogen có trong cơ thể người và là chất chống oxy hóa quan trọng, bảo vệ tế bào khỏi tổn thương. Công thức của (A) như sau:
(Công thức cấu tạo của Glutathione)
Biết rằng 1 nhóm S-H phản ứng với 1 phân tử NaOH. Khi đun nóng 0,11 mol (A) với dung dịch NaOH thì số mol NaOH phản ứng tối đa là bao nhiêu mol? (Làm tròn số đến hàng phần trăm)
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.
Thảo Linh là một tác giả và biên tập viên giàu kinh nghiệm tại DeThiTracNghiem.vn, chuyên cung cấp các bộ đề thi thử trắc nghiệm chất lượng cao, giúp học sinh và sinh viên ôn tập hiệu quả. Với sự am hiểu sâu rộng về giáo dục và kỹ năng biên soạn nội dung học thuật, Thảo Linh đã đóng góp nhiều bài viết giá trị, giúp người học tiếp cận kiến thức một cách hệ thống và dễ hiểu.




