Đề thi thử Đại học 2025 lần 1 môn Hóa học Trường THPT Chuyên Hạ Long (Quảng Ninh) là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi được biên soạn theo định hướng đề minh họa Tốt nghiệp THPT năm 2025 của Bộ GD&ĐT, có cấu trúc gồm 40 câu hỏi trắc nghiệm khách quan, trải dài từ mức độ nhận biết đến vận dụng cao. Nội dung chủ yếu tập trung vào chương trình Hóa học lớp 12 với các chuyên đề quan trọng như: Este – Lipit, Cacbohidrat, Amin – Amino axit – Protein, Polime, Đại cương kim loại, Kim loại kiềm – kiềm thổ – nhôm, Phản ứng oxi hóa – khử, bài toán điện phân và đồ thị hóa học.
Đặc trưng nổi bật của đề thi đến từ THPT Chuyên Hạ Long là các câu hỏi được thiết kế tinh tế, lồng ghép nhiều tình huống thực tế và dạng bài vận dụng, phù hợp với định hướng ra đề mới của Bộ. Đây là tài liệu tham khảo vô cùng giá trị không chỉ cho học sinh khá giỏi mà còn dành cho tất cả các thí sinh muốn luyện tập sâu sát với đề thi chính thức.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 THPT CHUYÊN HẠ LONG (QUẢNG NINH)



PHẦN I. CÂU TRẮC NGHIỆM NHIỀU PHƯƠNG ÁN LỰA CHỌN. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Tinh bột chứa hỗn hợp chất nào sau đây?
A. Glucose và fructose.
B. Amylose và amylopectin.
C. Glucose và galactose.
D. Amylose và cellulose.
Câu 2: Dung dịch nào sau đây có pH > 7?
A. NaOH.
B. NaCl.
C. CH3COOH.
D. H2SO4.
Câu 3: Có thể dùng tối đa bao nhiêu cách trong các cách sau đây để dập tắt đám cháy xăng dầu?
(a) Dùng chăn thấm ướt;
(b) Dùng bình cát;
(c) Dùng bình carbon dioxide;
(d) Dùng nước;
(e) Dùng bình bột khô ABC;
(g) Dùng bình chứa cháy dạng bột;
A. 6.
B. 4.
C. 5.
D. 3.
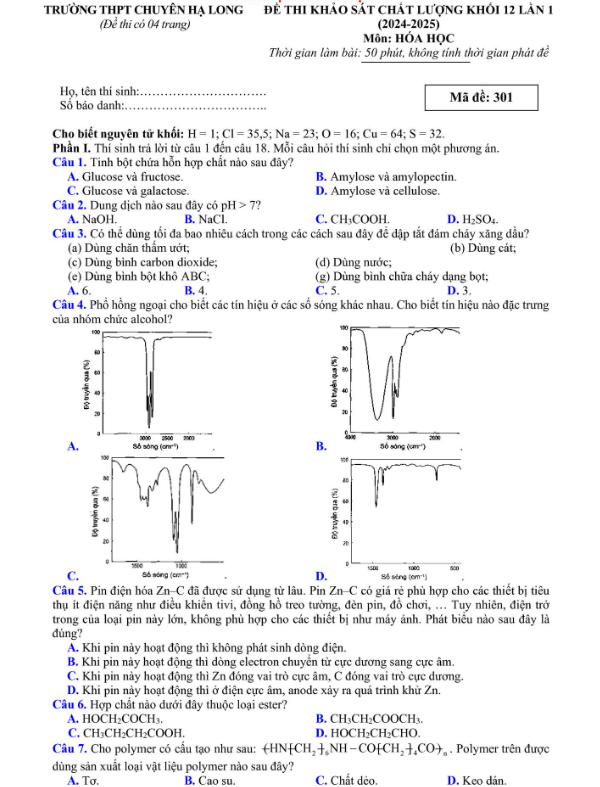
Câu 4: Phổ hồng ngoại cho biết các tín hiệu ở các số sóng khác nhau. Cho biết tín hiệu nào đặc trưng của nhóm chức alcohol?
A. 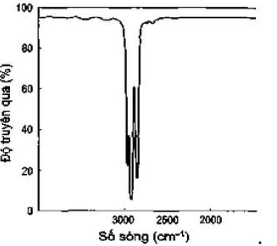
B. 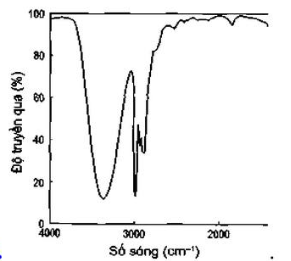
C.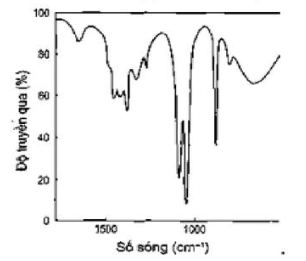
D.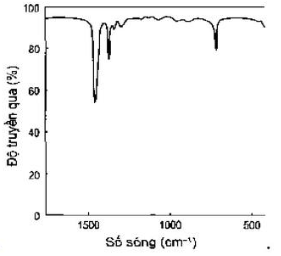
Câu 5: Pin điện hóa Zn-C đã được sử dụng từ lâu. Pin Zn-C có giá rẻ phù hợp cho các thiết bị tiêu thụ ít điện năng như đèn khiển, tivi, đồng hồ treo tường, đèn pin, đồ chơi,… Tuy nhiên, điện trở trong của loại pin này lớn, không phù hợp cho các thiết bị như máy ảnh. Phát biểu nào sau đây là đúng?
A. Khi pin này hoạt động thì không phát sinh dòng điện.
B. Khi pin này hoạt động thì dòng electron chuyển từ cực dương sang cực âm.
C. Khi pin này hoạt động thì Zn đóng vai trò cực âm, ở đó xảy vai trò sự khử.
D. Khi pin này hoạt động thì ở điện cực âm, anode xảy ra quá trình khử Zn.
Câu 6: Hợp chất nào dưới đây thuộc loại ester?
A. HOCH2COCH3.
B. CH3COOCH3.
C. CH3CH2COOH.
D. HOCH2CH2CHO.
Câu 7: Cho polymer có cấu tạo như sau: (-HN[CH2]6NH – CO[CH2]4CO-)n. Polymer trên được dùng sản xuất loại vật liệu polymer nào sau đây?
A. Tơ.
B. Cao su.
C. Chất dẻo.
D. Keo dán.
Câu 8: Một mẫu nước được thử nghiệm định tính để xác định sự có mặt của một số ion. Mẫu nước được cho vào 4 ống nghiệm, sau đó nhỏ mỗi loại thuốc thử vào mỗi ống nghiệm và ghi nhận hiện tượng như bảng dưới đây: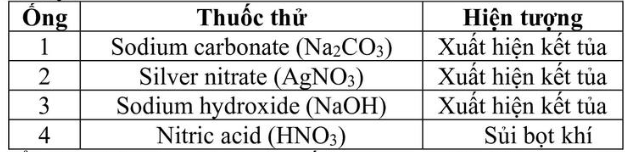 Mẫu nước trên có thể chứa những ion nào trong số các ion sau đây: (I) H+; (2) Ca2+; (3) Cl–; (4) HCO3–; (5) CO32-?
Mẫu nước trên có thể chứa những ion nào trong số các ion sau đây: (I) H+; (2) Ca2+; (3) Cl–; (4) HCO3–; (5) CO32-?
A. (1), (2), (3).
B. (3), (4), (5).
C. (2), (3), (5).
D. (2), (3), (4).
Câu 9: Cách làm nào sau đây là đúng trong việc khử chua bằng vôi và bón phân đạm cho lúa?
A. Bón đạm trước rồi vài ngày sau mới bón vôi khử chua.
B. Bón vôi khử chua trước rồi bón đạm ngay sau khi bón vôi.
C. Bón đạm và vôi cùng lúc.
D. Bón vôi khử chua trước rồi vài ngày sau mới bón đạm.
Câu 10: Suất điện động chuẩn của pin điện hoá gồm hai điện cực M2+/M và Ag+/Ag bằng 0,936 V, theo bảng sau: Kim loại M là
Kim loại M là
A. Cu.
B. Fe.
C. Ni.
D. Sn.
Câu 11: Bradykinin là một peptide được sản sinh từ huyết thanh trong máu, là chất làm giãn mạch máu và gây co trơn, chất trung gian gây ra tình trạng viêm. Công thức cấu tạo của bradykinin như hình dưới: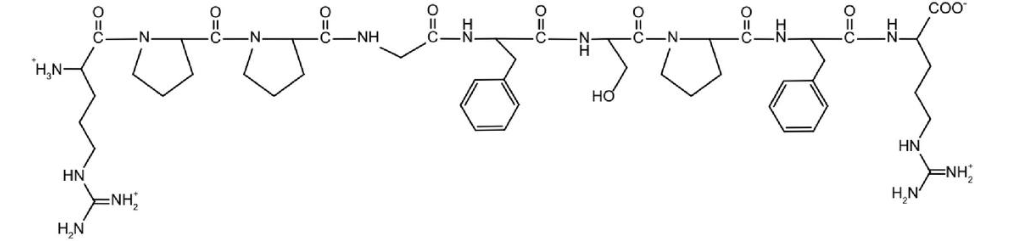 Thủy phân hoàn toàn 1 mol bradykinin thu được mấy loại amino acid khác nhau?
Thủy phân hoàn toàn 1 mol bradykinin thu được mấy loại amino acid khác nhau?
A. 4.
B. 6.
C. 5.
D. 3.
Câu 12: Phát biểu nào sau đây sai khi nói về enzyme?
A. Phần lớn enzyme là những protein xúc tác cho các phản ứng hóa học và sinh hóa.
B. Tốc độ phản ứng có xúc tác enzyme thường nhanh hơn nhiều lần so với với xúc tác hóa học.
C. Tốc độ phản ứng có xúc tác enzyme thường chậm hơn nhiều lần so với với xúc tác hóa học.
D. Enzyme có tính chọn lọc cao, mỗi enzyme chỉ xúc tác cho một hoặc một số phản ứng nhất định.
Câu 13: Ở điều kiện thường, trạng thái tồn tại của amino acid là
A. Thể rắn.
B. Thể lỏng.
C. Thể rắn và lỏng.
D. Thể khí.
Câu 14: Cấu hình electron ở phân lớp ngoài cùng của ion R+ là 2p6. Nguyên tử R là
A. 13Al.
B. 20Ca.
C. 10Ne.
D. 11Na.
Câu 15: Cho cơ chế phản ứng của propene với H2O như sau: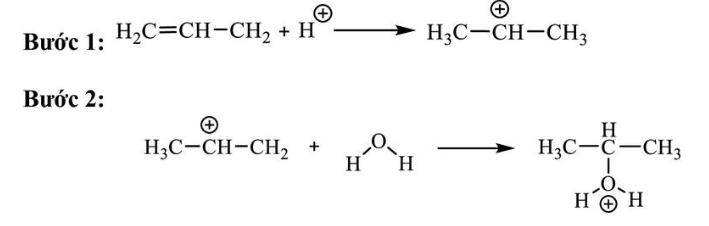 Phát biểu nào sau đây đúng?
Phát biểu nào sau đây đúng?
A. Ở bước 1, quá trình proton hóa liên kết đôi C=C của propene tạo thành carbocation.
B. Nếu thay H2O bằng HBr thì cơ chế phản ứng xảy ra tương tự.
C. Bước 2, quá trình tách proton để tạo thành alcohol.
D. Sản phẩm của phản ứng là sản phẩm chính theo quy tắc Markovnikov.
Câu 16: Cho phản ứng hóa học Fe + CuSO4 → FeSO4 + Cu. Trong phản ứng trên xảy ra
A. sự oxi hóa Fe và sự khử Cu.
B. sự khử Fe và sự oxi hóa Cu.
C. sự oxi hóa Fe và sự khử Cu2+.
D. sự khử Fe2+ và sự oxi hóa Cu.
Câu 17: Nguyên tử nguyên tố R có số electron là 25, vị trí của R trong bảng tuần hoàn là
A. chu kì 4, nhóm VIB.
B. chu kì 4, nhóm VIIB.
C. chu kì 4, nhóm VIIIA.
D. chu kì 4, nhóm IIA.
Câu 18: Dung dịch nào sau đây xảy ra phản ứng với ethyl acetate?
A. NaOH (to).
B. C2H5OH.
C. [Ag(NH3)2]OH.
D. NaCl.
PHẦN II. CÂU HỎI TRẮC NGHIỆM ĐÚNG SAI. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
Câu 1. Một nhóm học sinh đã thực hiện phản ứng điều chế ethyl acetate từ nguyên liệu ban đầu là acetic acid và ethanol trong phòng thí nghiệm. Khi phản ứng kết thúc, nhóm đã thu được hỗn hợp sản phẩm gồm ethyl acetate và acetic acid, ethanol còn dư theo phương trình hoá học: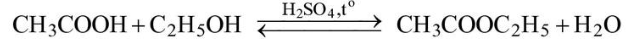
a) Phản ứng trên được gọi là phản ứng xà phòng hóa.
b) Vì ethyl acetate không phân cực, còn acetic acid và ethanol đều phân cực nên nhóm có thể dùng
dung môi hữu cơ không phân cực diethyl ether (C2H5OC2H5) để chiết ethyl acetate ra khỏi hỗn hợp
sau phản ứng.
c) Có thể thay dung dịch sulfuric acid đặc bằng dung dịch hydrochloric acid đặc.
d) Do diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate (34,6 C so với 77,1 C)
nên để thu được ethyl acetate có thể dùng nước nóng liên tục tưới lên bình cầu trong phương pháp
chưng cất đơn giản để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
Câu 2. Trong công nghiệp sản xuất bia có các bước chính sau: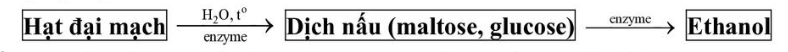 a) Thành phần trong hạt đại mạch bị thủy phân tạo ra maltose, glucose là tinh bột.
a) Thành phần trong hạt đại mạch bị thủy phân tạo ra maltose, glucose là tinh bột.
b) Để biết được thời điểm kết thúc quá trình thủy phân tinh bột ta có thể kiểm tra bằng thuốc thử
là dung dịch I2 trong KI.
c) Maltose và glucose thuộc nhóm monosaccharide, khi lên men thu được ethanol.
d) Sản phẩm thủy phân của tinh bột (hạt đại mạch), ngoài maltose và glucose còn thu được sản
phẩm phụ là fructose.
Câu 3. Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung
dịch sodium chloride có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine.
Chất khí này được làm khô (loại hơi nước) rồi hoa lỏng để làm nguyên liệu quan trọng cho nhiều
ngành công nghiệp chế biến và sản xuất hoa chất.
Từ quá trình điện phân nêu trên, một lượng chlorine và hydrogen sinh ra được tận dụng để sản xuất
hydrochloric acid đặc thương phẩm (37%, D = 1,19 g/mL ở 20o C).
Một nhà máy với quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được V m3 acid thương
phẩm trên (ở 20 C). Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng
hợp hydrochloric acid và hiệu suất của toàn bộ quá trình từ chlorine đến acid thương phẩm là 80%.
a) Có thể dùng sulfuric acid đặc làm khô khí chlorine thoát ra.
b) Trong thí nghiệm điện phân thì Cl2 sẽ thoát ra tại cực cathode.
c) Nếu không sử dụng màng ngăn xốp thì phương trình điện phân dung dịch NaCl là: 2NaCl + 2H2O > 2NaOH + H2 + Cl2
d) Giá trị của V là 237 (làm tròn đến hàng phần mười).
Câu 4. Trong bình kín có hệ cân bằng hóa học sau: CO2 (g) + H2 (g) ⇌ CO(g) + H2O(g); ΔrHo298 > 0
Cho các phát biếu về sự các tác động đến hệ cân bằng dưới đây, hãy xét tính đúng sai của các phát
biểu đó.
a) Tăng nhiệt độ của hệ thì cân bằng chuyển dịch theo chiều thuận.
b) Thêm chất xúc tác thì cân bằng chuyển dịch theo chiều thuận.
c) Giảm áp suất chung của hệ thì cân bằng chuyển dịch theo chiều nghịch.
d) Nếu nồng độ ban đầu CO2 và H2 đều là 0,03 M; tại cân bằng [CO]=0,018 M thì giá trị Kc là
1,5
PHẦN III. CÂU TRẮC NGHIỆM TRẢ LỜI NGẮN. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. KMnO4 là chất oxi hóa thường dùng trong việc xác định nồng độ các chất khử trong phòng thí nghiệm nhưng KMnO4 thường chưa đạt nồng độ nền là thế và ảnh hưởng đến kết quả thí nghiệm. Để xác định nồng độ chuẩn của dung dịch KMnO4 có nồng độ x.10-2 M (M) dùng dung dịch oxalic acid gốc theo các bước sau:
– Hòa tan hoan toan 0,505 gam oxalic acid ngam nuoc H2C2O4.2H2O (M=126,07) trong nuoc roi
pha thành 100 mL dung dịch X.
– Chuẩn độ 10,00 mL dung dịch X (trong môi trường sulfuric acid loãng, dư) bằng dung dịch
KMnO4 trên đến khi xuất hiện màu hồng nhạt thì dừng. Cho biết oxalic acid bị KMnO4 oxi hóa thành
CO2 và H2O trong môi trường acid.
– Lặp lại thí nghiệm chuẩn độ trên thêm 2 lần nữa. Thể tích trung bình của dung dịch KMnO4 sau
3 lần chuẩn độ là 12,75 mL.
Tính giá trị của x (làm tròn đáp án đến hàng phần mười).
Câu 2. Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam methane CH4(g) (làm tròn đến hàng phần trăm) để cung cấp nhiệt cho phản ứng tạo 1,5 mol CaO bằng cách nung CaCO3. Giá thiết hiệu suất các quá trình đều là 100%. Phương trình nhiệt của phản ứng nung vôi và đốt cháy methane như sau: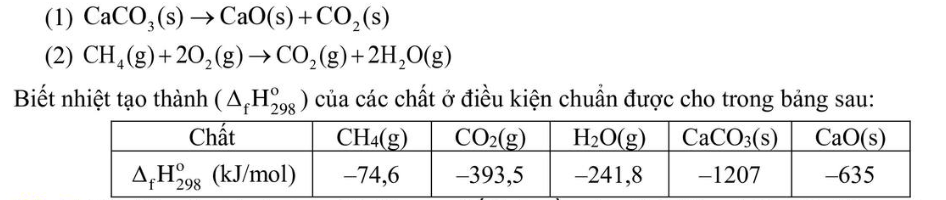
Câu 3. Xà phòng hoá hoàn toàn 17,24 gam chất béo cần vừa đủ 0,06 mol NaOH. Cô cạn dung dịch sau phản ứng thu được khối lượng xà phòng là bao nhiêu gam? (làm tròn đáp án đến hàng phần mười)
Câu 4. Hoà tan m gam kim thể CuSO4.5H2O vào nước thu được dung dịch X. Điện phân dung dịch X với điện cực trơ và cường độ dòng điện không đổi. Nếu thời gian điện phân là t (s) thì thu được kim loại Cu ở cathode và 208,236 ml khí tại anode. Nếu thời gian điện phân là 2t (s) thì thu được 713,952 ml khí. Biết thể tích các khí đo ở đkc. Tính giá trị của m (làm tròn đáp án đến hàng phần mười).
Câu 5. Fructose có công thức phân tử C6H12O6. Tương tự glucose, fructose tồn tại đồng thời dạng mạch hở và mạch vòng (α và β). Ở dạng mạch vòng α-fructose, tổng số nhóm –OH hemiacetal và –OH hemiketal trong phân tử fructose là bao nhiêu?
Câu 6. Ứng với công thức phân tử C2H7O2N có bao nhiêu chất vừa phản ứng được với dung dịch NaOH, vừa phản ứng được với dung dịch HCl?
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các cơ sở giáo dục đại học, cao đẳng tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên cả nước, làm cơ sở để điều chỉnh nội dung, phương pháp dạy học trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 phải tham gia 3 bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh chọn một trong hai bài thi tổ hợp:
Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí, Giáo dục công dân (đối với học sinh chương trình GDPT).
Trong bài thi tổ hợp KHTN, môn Hóa học là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học, trừ khi chọn bài thi tổ hợp KHTN để xét tốt nghiệp hoặc phục vụ mục tiêu xét tuyển đại học, cao đẳng vào các ngành có yêu cầu môn Hóa học.
Vì vậy, Đề thi thử tốt nghiệp THPT 2025 lần 1 môn Hóa học do Trường THPT Chuyên Hạ Long (Quảng Ninh) ban hành là tài liệu luyện tập hữu ích dành cho thí sinh chọn tổ hợp KHTN. Đề giúp các em học sinh ôn tập có trọng tâm, tự đánh giá năng lực bản thân, nâng cao kỹ năng làm bài và chuẩn bị tốt cho kỳ thi chính thức sắp tới.




