Đề thi thử Đại học 2025 môn Hóa học Sở GD&ĐT Thái Nguyên là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi thử tốt nghiệp THPT 2025 môn Hóa học Sở GD&ĐT Thái Nguyên được xây dựng với định hướng rõ ràng, bám sát cấu trúc đề minh họa mới nhất của Bộ GD&ĐT. Đề thi bao gồm đầy đủ các chuyên đề trọng yếu của chương trình Hóa học lớp 12 như: phản ứng oxi hóa – khử, dãy điện hóa, kim loại – phi kim, este – cacbohidrat, amin – peptit – protein, điện phân, bài toán đồ thị và dạng bài thực tiễn gắn với đời sống.
Đề được đánh giá có độ phân hóa tốt, phù hợp cho cả học sinh trung bình khá lẫn học sinh khá giỏi, với những câu hỏi ở mức vận dụng và vận dụng cao. Ngoài ra, cách sắp xếp các câu hỏi logic theo mức độ khó tăng dần sẽ giúp học sinh làm quen với nhịp độ phòng thi thật, từ đó cải thiện chiến lược phân bổ thời gian làm bài.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GD&ĐT THÁI NGUYÊN
PHẦN I. (4,5 điểm) Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Thủy phân triolein có công thức (C₁₇H₃₃COO)₃C₃H₅ trong dung dịch NaOH, thu được glycerol và muối X. Công thức của X là
A. C₁₇H₃₅COONa.
B. CH₃COONa.
C. C₁₇H₃₃COONa.
D. C₂H₅COONa.
Câu 2. Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng Phản ứng nào sau đây đúng?
Phản ứng nào sau đây đúng?
A. 3Zn + 2Cr³⁺ → 3Zn²⁺ + 2Cr.
B. Ni + 2Cr³⁺ → Ni²⁺ + 2Cr²⁺.
C. Zn + 2Cr³⁺ → Zn²⁺ + 2Cr²⁺.
D. Zn + Cr²⁺ → Zn²⁺ + Cr.
Câu 3. X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. 1s²2s²2p⁶3s²3p⁵.
B. 1s²2s²2p⁶3s²3p⁴.
C. 1s²2s²2p⁶3s²3p³.
D. 1s²2s²2p⁶3s²3p².
Câu 4. X là hợp chất dùng làm thuốc gây mê toàn thân theo đường thở. Nó cũng có tác dụng giảm đau và giãn cơ. Hợp chất hữu cơ X có phổ khối lượng như hình dưới đây. Hợp chất hữu cơ X có thể là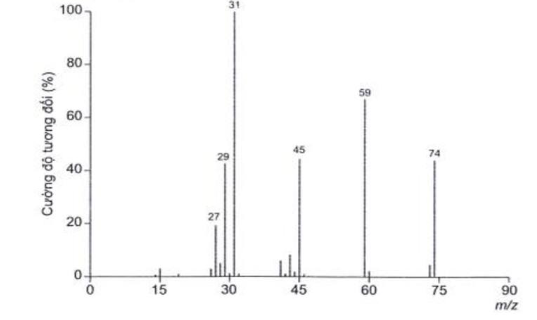
A. C₄H₁₀.
B. CH₂Cl₂.
C. C₄H₁₀O.
D. C₄H₈O₂.
Câu 5. Acquy chì có cấu tạo như hình vẽ dưới đây: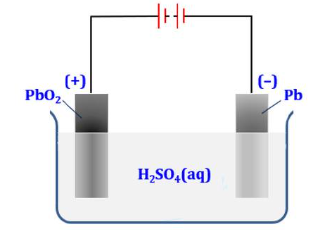 Cực dương là thanh than chì (C) được phủ PbO₂ và cực âm là tấm chì (Pb), cùng nhúng vào dung dịch H₂SO₄ nồng độ 28%. Phản ứng xảy ra khi acquy xả điện là:
Cực dương là thanh than chì (C) được phủ PbO₂ và cực âm là tấm chì (Pb), cùng nhúng vào dung dịch H₂SO₄ nồng độ 28%. Phản ứng xảy ra khi acquy xả điện là:
Pb(s) + PbO₂(s) + 2H₂SO₄ (aq) → 2PbSO₄(s) + 2H₂O(l)
Biết rằng PbSO₄ sinh ra từ điện cực nào đều bám hết vào điện cực đó. Cho các phát biểu sau:
(a) Tại anode, Pb bị khử và tạo thành PbSO₄.
(b) Tại cathode, PbO₂ bị oxi hoá và tạo thành PbSO₄.
(c) Khi acquy xả điện, khối lượng các điện cực giảm xuống.
(d) Khi acquy xả điện, nồng độ H₂SO₄ trong acquy nhỏ hơn 28%.
Số phát biểu đúng là
A. 3.
B. 2. (Phát biểu đúng là (d). Phát biểu (a) sai – Pb bị oxi hóa tại anode. (b) sai – PbO2 bị khử tại cathode. (c) sai – khối lượng điện cực tăng do tạo PbSO4)
C. 1.
D. 4.
Câu 6. Alanine, ký hiệu là Ala là một amino acid được sử dụng trong quá trình sinh tổng hợp protein. Trong dung dịch ở pH khác nhau, alanine sẽ tồn tại ở các dạng như dưới đây: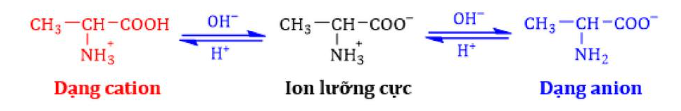 Ở pH = 6 alanine tồn tại chủ yếu ở dạng ion lưỡng cực có tổng điện tích bằng không. Khi đặt trong điện trường, alanine hầu như không di chuyển.
Ở pH = 6 alanine tồn tại chủ yếu ở dạng ion lưỡng cực có tổng điện tích bằng không. Khi đặt trong điện trường, alanine hầu như không di chuyển.
Nhận định nào sau đây về alanine là không đúng?
A. Alanine là một α-amino acid.
B. Trong môi trường kiềm, dạng tồn tại của alanine là dạng anion.
C. Alanine có tính lưỡng tính.
D. Ở pH < 6, alanine nhận proton trở thành anion, khi đặt trong điện trường di chuyển về cực dương.
Câu 7. Cơ thể người sử dụng phân tử nào sau đây để xây dựng protein?
A. Chất béo.
B. Tinh bột.
C. Acid béo.
D. Amino acid.
Câu 8. Điểm chớp cháy là nhiệt độ thấp nhất ở áp suất của khí quyển mà một chất lỏng hoặc vật liệu dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc với nguồn lửa.
– Điểm chớp cháy được sử dụng để phân biệt chất lỏng dễ cháy với chất lỏng có thể gây cháy:
+ Chất lỏng có điểm chớp cháy <37,8°C gọi là chất lỏng dễ cháy.
+ Chất lỏng có điểm chớp cháy >37,8°C gọi là chất lỏng có thể gây cháy.
Cho bảng số liệu sau: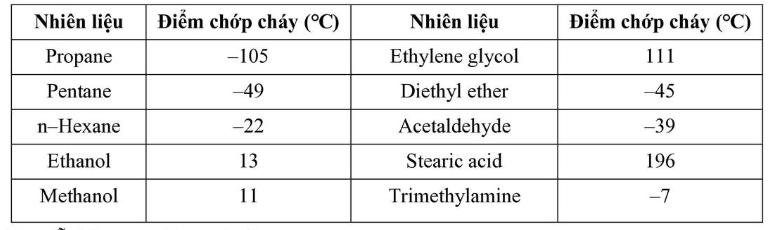 Số chất lỏng dễ cháy trong bảng trên là
Số chất lỏng dễ cháy trong bảng trên là
A. 9.
B. 8.
C. 6.
D. 7.
Câu 9. Amine nào sau đây là amine bậc hai?
A. CH₃CH₂CH₂NH₂.
B. CH₃CH(NH₂)CH₃.
C. (CH₃)₃N.
D. CH₃NHCH₂CH₃.
Câu 10. Cho hai quá trình sau:
NH₄NO₃(s) → N₂O(g) + 2H₂O(g) ∆rH⁰298 = -36 KJ
NH₄Cl(s) → NH₃(g) + HCl(g) ∆rH⁰298 = 176 KJ
Trong cùng điều kiện về môi trường thì
A. cả hai loại muối này đều có nguy cơ cháy nổ cao.
B. cả hai loại muối này đều rất an toàn, không có nguy cơ cháy nổ.
C. ammonium nitrate có nguy cơ cháy nổ cao hơn.
D. ammonium chloride có nguy cơ cháy nổ cao hơn.
Câu 11. Ester X được tạo bởi methyl alcohol và acetic acid. Công thức của X là
A. HCOOCH₃.
B. CH₃COOC₂H₅.
C. HCOOC₂H₅.
D. CH₃COOCH₃.
Câu 12. Cho phản ứng hóa học: 4Cr + 3O₂ → 2Cr₂O₃. Trong phản ứng trên xảy ra
A. sự khử Cr và sự khử O₂.
B. sự khử Cr và sự oxi hóa O₂.
C. sự oxi hóa Cr và sự oxi hóa O₂.
D. sự oxi hoá Cr, và sự khử O₂.
Câu 13. PVC là chất rắn vô định hình, cách điện tốt, bền với acid, được dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa, PVC được tổng hợp trực tiếp từ monomer nào sau đây?
A. Vinyl acetate.
B. Propylene.
C. Vinyl chloride.
D. Acrylonitrile.
Câu 14. Dây điện cao thế thường được làm bằng aluminium (nhôm) do aluminium
A. có tính trơ về mặt hoá học.
B. có giá thành rẻ.
C. là kim loại dẫn điện tốt và nhẹ.
D. là kim loại dẫn điện tốt nhất.
Câu 15. X là kim loại phản ứng được với dung dịch H₂SO₄ loãng, Y là kim loại tác dụng được với dung dịch Fe(NO₃)₃. Hai kim loại X, Y có thể là
A. Cu, Fe.
B. Mg, Ag.
C. Fe, Cu.
D. Ag, Mg.
Câu 16. Trong vỏ Trái Đất, những kim loại nào sau đây tồn tại chủ yếu dưới dạng đơn chất.
A. Ag, Au.
B. Mg, Al.
C. Zn, Fe.
D. Na, Ba.
Câu 17. Tinh bột thuộc loại polysaccharide, là một trong những chất dinh dưỡng cơ bản của người và động vật. Phân tử tinh bột được tạo thành từ nhiều gốc
A. α-fructose.
B. β-fructose.
C. α-glucose.
D. β-glucose.
Câu 18. Cho phương trình hóa học của phản ứng giữa ethylene với hydro chloride tạo ethyl chloride như sau: CH₂=CH₂ + HCl → CH₃ – CH₂Cl
Cơ chế của phản ứng trên diễn ra theo 2 giai đoạn: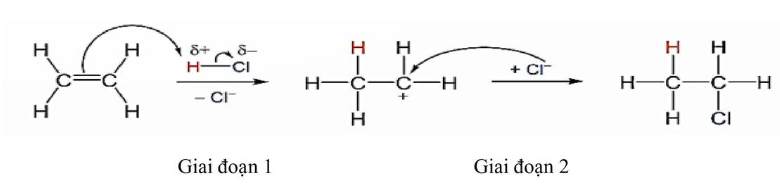 Nhận định nào sau đây không đúng?
Nhận định nào sau đây không đúng?
A. Phản ứng trên là phản ứng cộng.
B. Trong giai đoạn 1 xảy ra sự phá vỡ liên kết π tạo thành carbocation.
C. Giai đoạn 2, carbocation kết hợp với anion hình thành sản phẩm.
D. Trong phân tử ethylene có 6 liên kết σ.
PHẦN II. (4,0 điểm) Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Linalyl acetate là một trong những chất của tinh dầu cam và mùi thơm của hoa oải hương. Cho công thức cấu tạo của linalyl acetate như sau: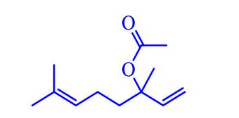 a) Linalyl acetate có vùng hấp thụ trên phổ hồng ngoại (IR) ở khoảng sóng với peak đặc trưng với số sóng có giá trị từ 3650 – 3200 cm⁻¹.
a) Linalyl acetate có vùng hấp thụ trên phổ hồng ngoại (IR) ở khoảng sóng với peak đặc trưng với số sóng có giá trị từ 3650 – 3200 cm⁻¹.
b) Hydrogen hóa hoàn toàn linalyl acetate thu được ester có công thức phân tử là C₁₂H₂₄O₂.
c) Phân tử linalyl acetate có 2 gốc methylene (-CH₂-).
d) Linalyl acetate có đồng phân hình học.
Câu 2. Sắt có số hiệu nguyên tử là 26. Trong vỏ Trái Đất, sắt là nguyên tố kim loại phổ biến thứ 2 (sau nhôm). Ứng dụng chủ yếu của sắt là để tạo ra các hợp kim thép dùng trong xây dựng và chế tạo.
a) Ion Fe³⁺ có cấu hình electron [Ar]3d⁵.
b) Ở trạng thái cơ bản, nguyên tử Fe có 6 electron ở lớp ngoài cùng.
c) Kim loại sắt tác dụng với chlorine dư tạo ra sản phẩm là FeCl₂.
d) Trong vỏ Trái Đất, sắt tồn tại ở dạng hợp chất chủ yếu trong các quặng.
Câu 3. Máy tạo nhịp tim là một thiết bị nhỏ dùng để điều trị một số chứng rối loạn nhịp tim. Khi bị rối loạn nhịp tim, tim có thể đập quá nhanh, quá chậm hoặc nhịp tim không đều. Máy tạo nhịp tim gửi các xung điện để giúp tim đập ở tốc độ và nhịp điệu bình thường. Máy tạo nhịp tim gồm có 2 phần chính: máy tạo nhịp (Pacemaker) và dây điện cực (Electrode). Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa, hiện nay pin của máy tạo nhịp thường được sử dụng là pin Lithium – Iodine (gồm hai cặp oxi hóa khử Li⁺/Li và I₂/2I⁻).
Cho biết: E⁰(Li⁺/Li) = –3,04V, E⁰(I₂/2I⁻) = +0,54V ; M(Li) = 6,9 ; điện tích của 1 mol electron là 96500 C/mol; q = I.t, trong đó q là điện tích (C), I là cường độ dòng điện (A), t là thời gian (s), 1 năm = 365 ngày.
a) Máy tạo nhịp tim có thể được đặt tạm thời hay vĩnh viễn trong cơ thể tùy theo tình trạng sức khỏe và các bệnh lý kèm theo của bệnh nhân.
b) Khi pin hoạt động lithium đóng vai trò là anode, tại anode xảy ra quá trình khử.
c) Sức điện động chuẩn của pin E⁰pin = +3,58V.
d) Nếu pin tạo ra một dòng điện ổn định bằng 2,5.10⁻⁵ A thì một pin được chế tạo bởi 0,5 gam lithium có thể hoạt động tối đa trong thời gian 8 năm.
Câu 4. Để tạo ra mật ong, mỗi con ong thợ phải sử dụng những chiếc vòi của mình hút mật từ hoa và lưu trữ nó trong túi dạ dày đặc biệt. Mỗi túi mật có thể lưu trữ đến gần 70mg mật hoa. Để đầy túi dạ dày, mỗi con ong cần từ 100 đến 1500 bông hoa, tùy thuộc vào loại hoa và năng lượng cần thiết. Sau khi túi dạ dày đầy, chúng trở về tổ và chuyển mật hoa cho những con ong thợ khác, ong thợ nhận mật hoa và lưu giữ trong miệng của mình. Sau đó, trong khoảng nửa tiếng, chúng “nhai” mật hoa, cho phép enzim trong miệng phân hủy các loại đường phức tạp trong mật hoa thành các loại đường đơn giản.
a) Không nên đựng mật ong trong những chai bằng kim loại, do dưới tác dụng của enzyme, một phần đường trong mật ong sẽ biến thành acid. Chất này ăn mòn lớp kim loại làm tăng hàm lượng kim loại trong mật ong, làm mật biến chất không tốt cho sức khỏe.
b) Trong quá trình lưu trữ mật ong, có một lượng nhỏ đường lên men C₆H₁₂O₆ –(enzyme)–> 2C₂H₅OH + 2CO₂, nên mật ong để lâu có hiện tượng sủi bọt khí.
c) Trong thành phần mật ong có khoảng 40% đường fructose, 30% đường glucose, 30% nước, vitamin, khoáng chất…
d) Glucose và fructose trong mật ong đều tác dụng được với CH₃OH (xt HCl; t⁰), nước bromine, thuốc thử tollens.
PHẦN III: (1,5 điểm) Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Một nhà máy luyện kim sản xuất nhôm bằng cách điện phân nóng chảy 20 tấn quặng bauxit (chứa 47% Al₂O₃ về khối lượng, còn lại là tạp chất không chứa nhôm, hiệu suất quá trình đạt 85%). Toàn bộ lượng nhôm tạo ra được đúc thành k thanh nhôm hình hộp chữ nhật có chiều dài 110 cm, chiều rộng 20 cm, chiều cao 10 cm. Biết khối lượng riêng của nhôm là 2,7 g/cm³. Giá trị của k bằng bao nhiêu? (Kết quả làm tròn đến hàng đơn vị).
Câu 2. Cyanide (CN⁻) là một loại chất độc hại thường được tìm thấy trong nước thải của các công ty khai thác quặng kim loại vàng. Do cyanide có khả năng tạo phức mạnh với kim loại, các công ty khai thác mỏ đã kiếm được lợi nhuận khổng lồ từ việc sử dụng cyanide để tách Au từ quặng của nó. Theo tiêu chuẩn Việt Nam, hàm lượng cyanide trong nước thải của các nhà máy phải xử lí trong khoảng 0,05 – 0,2 mg/lít trước khi thải ra môi trường. Phân tích một mẫu nước thải của một nhà máy người ta đo được hàm lượng ion cyanide là x mg/lít. Để làm giảm hàm lượng cyanide đến 0,12 mg/lít người ta sục khí Cl₂ vào nước thải trong môi trường có pH = 9. Khi đó cyanide chuyển thành nitrogen không độc theo sơ đồ phản ứng:
CN⁻ + OH⁻ + Cl₂ → CO₂ + Cl⁻ + H₂O + N₂
Biết thể tích khí chlorine (ở đkc) cần thiết để xử lí cyanide trong 1000 m³ nước thải trên là 232,40625 m³. Giá trị của x bằng bao nhiêu? Kết quả làm tròn đến hàng phần mười
Câu 3. Xà phòng hóa hoàn toàn triglyceride X trong dung dịch NaOH dư, thu được sodium linoleate và sodium palmitate tỉ lệ 2:1 về số mol. Phân tử khối của X bằng bao nhiêu amu?
Câu 4. Cho các phản ứng được đánh số thứ tự từ 1 tới 5 dưới đây:
(1) Glucose phản ứng thuốc thử Tollens.
(2) Glucose phản ứng với nước bromine.
(3) Glucose phản ứng với methanol khi có mặt HCl khan xúc tác.
(4) Cellulose phản ứng với HNO₃ đặc có mặt H₂SO₄ đặc, đun nóng.
(5) Saccharose thủy phân trong môi trường acid.
Hãy liệt kê các phản ứng oxi hóa – khử theo số thứ tự tăng dần?
Câu 5. Trong phản ứng quang hợp, thực vật sử dụng năng lượng mặt trời để tạo thành glucose theo phản ứng hóa học sau: 6CO₂(g) + 6H₂O(l) → C₆H₁₂O₆(s) + 6O₂(g)
Cho nhiệt tạo thành chuẩn của các chất
 Cho biết: Mỗi phút (trời nắng), 1 cm² lá cây hấp thụ 2,09 J năng lượng mặt trời, trong đó 10% năng lượng đó được dùng trong phản ứng quang hợp tạo glucose và chỉ 10% glucose được chuyển hóa thành tinh bột. Giả sử 1 cây sắn dây có 400 lá, mỗi lá có diện tích 35 cm². Để thu hoạch được 15kg củ sắn dây từ cây trên cần bao nhiêu ngày? Biết trong củ sắn dây chỉ chứa 15% tinh bột, thời gian mặt trời chiếu sáng trong 1 ngày là 10 giờ. (Kết quả làm tròn đến hàng đơn vị).
Cho biết: Mỗi phút (trời nắng), 1 cm² lá cây hấp thụ 2,09 J năng lượng mặt trời, trong đó 10% năng lượng đó được dùng trong phản ứng quang hợp tạo glucose và chỉ 10% glucose được chuyển hóa thành tinh bột. Giả sử 1 cây sắn dây có 400 lá, mỗi lá có diện tích 35 cm². Để thu hoạch được 15kg củ sắn dây từ cây trên cần bao nhiêu ngày? Biết trong củ sắn dây chỉ chứa 15% tinh bột, thời gian mặt trời chiếu sáng trong 1 ngày là 10 giờ. (Kết quả làm tròn đến hàng đơn vị).
Câu 6. Có tổng số bao nhiêu peptide trong các chất sau:
H₂N-CH₂-CO-NH-CH(CH₃)-COOH (1)
H₂N-CH(CH₂-C₆H₅)-CO-NH-CH₂-COOH (2)
H₂N-CH₂-CH₂-CO-NH-CH₂-COOH (3)
H₂N-CH₂-COOH (4)
H₂N-CH(CH₃)-CO-NH-CH₂-COOH (5)
H₂N-CH₂-CO-NH-CH₂-COOH (6)
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các cơ sở giáo dục đại học, cao đẳng tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên cả nước, làm cơ sở để điều chỉnh nội dung, phương pháp dạy học trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 phải tham gia 3 bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh lựa chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí, Giáo dục công dân (đối với học sinh chương trình GDPT).
Trong bài thi tổ hợp KHTN, môn Hóa học là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học, trừ khi chọn bài thi tổ hợp KHTN để xét tốt nghiệp hoặc phục vụ mục tiêu xét tuyển đại học, cao đẳng vào các ngành có yêu cầu môn Hóa học.
Vì vậy, Đề thi thử tốt nghiệp THPT 2025 môn Hóa học do Sở Giáo dục và Đào tạo Thái Nguyên ban hành là tài liệu luyện tập hữu ích dành cho học sinh chọn tổ hợp KHTN. Đề thi giúp các em ôn tập, tự đánh giá năng lực hiện tại, rèn luyện kỹ năng làm bài và chuẩn bị tốt nhất cho kỳ thi chính thức.




