Đề thi thử đánh giá năng lực môn Hóa học 2025 – Bám sát đề minh họa – Đề 9 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi bao gồm các câu hỏi trải đều trên toàn bộ chương trình Hóa học lớp 12, tập trung vào những chuyên đề trọng tâm như: phản ứng oxi hóa – khử, kim loại và hợp chất, phi kim, điện phân, este – lipit, amin – amino axit – peptit, polime, hóa học hữu cơ – vô cơ đại cương. Các câu hỏi được sắp xếp logic theo mức độ từ cơ bản đến nâng cao, giúp học sinh từng bước chinh phục từng dạng bài và cải thiện tốc độ cũng như độ chính xác khi làm bài trắc nghiệm.
Hãy cùng Dethitracnghiem.vn chinh phục đề số 9, rèn luyện kỹ năng giải đề chuyên sâu và sẵn sàng bứt phá trong kỳ thi tốt nghiệp THPT 2025 sắp tới!
- Số trang: 4 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐÁNH GIÁ NĂNG LỰC MÔN HÓA HỌC NĂM 2025 – BÁM SÁT ĐỀ MINH HỌA – ĐỀ 9







PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
Câu 1: Cho khối lượng riêng của các chất như bảng sau: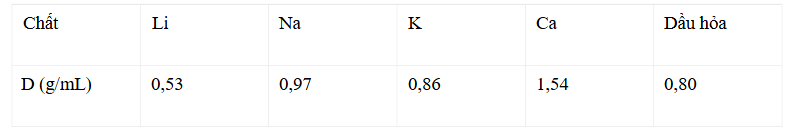 Để bảo quản một số kim loại mạnh, người ta thường ngâm chìm kim loại đó trong dầu hỏa. Trong số các kim loại trên, có bao nhiêu kim loại bảo quản được trong dầu hỏa?
Để bảo quản một số kim loại mạnh, người ta thường ngâm chìm kim loại đó trong dầu hỏa. Trong số các kim loại trên, có bao nhiêu kim loại bảo quản được trong dầu hỏa?
A. 3.
B. 4.
C. 1.
D. 2.
Câu 2: Cho phản ứng: Fe + 2HCl → FeCl₂ + H₂. Chất oxi hóa là
A. FeCl₂.
B. H₂.
C. Fe.
D. HCl.
Câu 3: Calcium hydrogencarbonate là một trong những chất gây nên tính cứng tạm thời của nước. Công thức của hợp chất này là
A. Ca(HSO₃)₂.
B. Ca(HCO₃)₂.
C. Mg(HCO₃)₂.
D. CaCO₃.
Câu 4: Phát biểu nào sau đây đúng?
A. Những electron ở phân lớp 3d, 4d có mức năng lượng bằng nhau.
B. Electron ở orbital 3d có mức năng lượng cao hơn electron ở orbital 4s.
C. Electron ở orbital 2p có mức năng lượng thấp hơn electron ở orbital 2s.
D. Những electron ở lớp L có mức năng lượng bằng nhau.
Câu 5: “Dựa trên các số sóng hấp thụ đặc trưng trên phổ IR có thể dự đoán …(?)… trong phân tử chất nghiên cứu”. Nội dung phù hợp trong dấu “……” là
A. nhóm chức.
B. số lượng nhóm chức.
C. độ dài liên kết.
D. khối lượng.
Câu 6: Cho các polymer sau: (1) tơ tằm; (2) sợi bông; (3) tơ visco; (4) tơ capron; (5) tơ cellulose acetate. Những polymer có nguồn gốc từ cellulose là
A. (1), (4), (5).
B. (1), (2), (3).
C. (2), (3), (5).
D. (3), (4), (5).
Câu 7: Điểm chớp cháy của một chất là nhiệt độ thấp nhất ở áp suất của khí quyển mà chất lỏng chảy dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi gặp nguồn phát tia lửa. Chất lỏng có điểm chớp cháy nhỏ hơn 37,8°C là chất lỏng dễ cháy, trong khi chất lỏng có điểm chớp cháy lớn hơn 37,8°C là chất lỏng có thể gây cháy. Cho điểm chớp cháy của một số nhiên liệu lỏng như bảng sau
Cho các phát biểu sau:
(a) Nguy cơ gây hỏa hoạn của cồn cao hơn acetone và xăng.
(b) Xăng dễ bắt cháy hơn dầu hỏa.
(c) Biodiesel là nhiên liệu có nguy cơ gây hỏa hoạn thấp hơn xăng.
(d) Xăng, acetone, cồn và dầu hỏa là chất lỏng dễ cháy, trong khi biodiesel là chất lỏng có thể gây cháy.
Các phát biểu đúng là
A. (c), (d).
B. (a), (b).
C. (b), (d).
D. (b), (c).
Câu 8: Cách làm nào sau đây là đúng trong việc khử chua bằng vôi và bón phân đạm (urea hoặc ammonium) cho lúa?
A. Bón vôi trước rồi vài ngày sau mới bón đạm.
B. Bón vôi trước rồi bón đạm ngay sau khi bón vôi.
C. Bón đạm trước rồi vài ngày sau mới bón vôi.
D. Bón đạm và vôi cùng lúc.
Câu 9: Phương pháp được dùng hiện nay để tách các kim loại hoạt động hóa học mạnh là
A. nhiệt luyện.
B. thuỷ luyện.
C. điện phân dung dịch.
D. điện phân nóng chảy.
Câu 10: Tùy theo pH môi trường mà amino acid có thể tồn tại dưới dạng tích điện âm, tích điện dương hoặc trung hòa về điện (ion lưỡng cực). Giá trị pH mà tại đó amino acid tồn tại ở dạng ion lưỡng cực gọi là pH đồng điện hay pI. Giá trị pI của glutamic acid, glycine, arginine được cho dưới đây: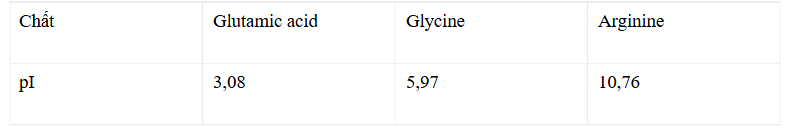 Cho các phát biểu sau về quá trình điện di hỗn hợp X gồm glutamic acid, glycine và arginine:
Cho các phát biểu sau về quá trình điện di hỗn hợp X gồm glutamic acid, glycine và arginine:
(a) Với môi trường pH = 5,97 glycine hầu như không di chuyển trong điện trường.
(b) Với môi trường pH = 5,97 glutamic acid trở thành cation và di chuyển về cực âm.
(c) Với môi trường pH = 5,97 arginine trở thành dạng anion và di chuyển về cực dương.
(d) Với môi trường pH = 5,97 có thể tách riêng các amino acid trong hỗn hợp X.
Các nhận định đúng là
A. (a), (d).
B. (a), (b).
C. (c), (d).
D. (b), (c).
Câu 11: Thủy phân hoàn toàn 1 mol chất béo, thu được
A. 3 mol glycerol.
B. 1 mol glycerol.
C. 3 mol ethylene glycol.
D. 1 mol ethylene glycol.
Câu 12: Phương trình hóa học của phản ứng thủy phân tert-butyl bromide trong môi trường kiềm là
(CH₃)₃C-Br + NaOH → (CH₃)₃COH + NaBr
Cơ chế phản ứng xảy ra theo hai giai đoạn sau: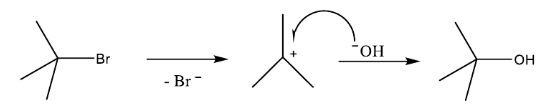 Nhận định nào sau đây không đúng?
Nhận định nào sau đây không đúng?
A. Sản phẩm hữu cơ thu được có tên là tert-butyl alcohol.
B. Liên kết C–O trong phân tử (CH₃)₃COH được hình thành do xen phủ trục của các orbital.
C. Trong giai đoạn 1 có sự phân cắt liên kết xích ma.
D. Phản ứng thủy phân tert-butyl bromide là phản ứng trao đổi.
Câu 13: Cho biết giá trị thế điện cực chuẩn (E°) của các cặp oxi hoá – khử sau: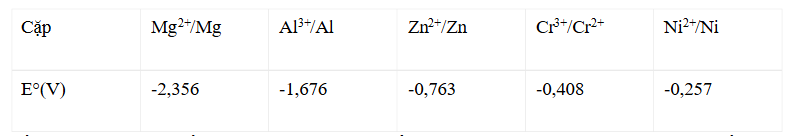 Số kim loại trong dãy gồm: Mg, Al, Zn và Ni có thể khử được ion Cr³⁺(aq) tạo ra Cr²⁺(aq) ở điều kiện chuẩn là
Số kim loại trong dãy gồm: Mg, Al, Zn và Ni có thể khử được ion Cr³⁺(aq) tạo ra Cr²⁺(aq) ở điều kiện chuẩn là
A. 2.
B. 3.
C. 1.
D. 4.
Câu 14: Nhỏ vài giọt dung dịch iodine vào lát cắt củ khoai tây, ta thấy tại lát cắt củ khoai tây chuyển màu
A. da cam.
B. đỏ.
C. xanh tím.
D. nâu đen.
Câu 15: Phát biểu nào sau đây đúng?
A. Gly-Ala-Ala có phản ứng màu biuret.
B. Aniline là chất khí tan nhiều trong nước.
C. Phân tử Gly-Ala có bốn nguyên tử oxygen.
D. Dung dịch glycine làm quỳ tím chuyển màu đỏ.
Câu 16: Hai kim loại X, Y và các dung dịch muối
X + 2YCl₃ → XCl₂ + 2YCl₂
Y + XCl₂ → YCl₂ + X
Phát biểu nào sau đây là đúng?
A. Ion Y²⁺ có tính oxi hóa mạnh hơn ion X²⁺.
B. Kim loại X có tính khử mạnh hơn kim loại Y.
C. Ion Y³⁺ có tính oxi hoá mạnh hơn ion X²⁺.
D. Kim loại X khử được ion Y²⁺.
Câu 17: Chất dưới đây là một tripeptide?
A. Val.
B. Gly-Gly-Ala-Val.
C. Gly-Ala-Val.
D. Gly-Ala.
Câu 18: Chất nào sau đây là thành phần chính của chất giặt rửa tổng hợp?
A. CH₃[CH₂]₁₄COONa.
B. C₃H₅(OH)₃.
C. CH₃[CH₂]₁₄COOK.
D. CH₃[CH₂]₁₁C₆H₄SO₃Na.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Cho pin điện hóa được thiết lập bởi điện cực Zn và điện cực hydrogen (cấu tạo như hình vẽ) dung dịch Zn²⁺ (aq) 1 M và dung dịch H⁺ (aq) 1 M có thể tích bằng nhau, suất điện động chuẩn của pin đo được là 0,76 V.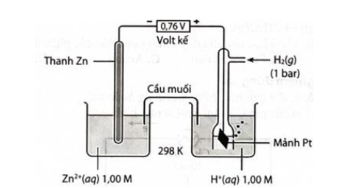 a) Thế điện cực chuẩn của cặp oxi hóa – khử Zn²⁺/Zn là 0,76 V.
a) Thế điện cực chuẩn của cặp oxi hóa – khử Zn²⁺/Zn là 0,76 V.
b) Pin hoạt động đến khi nồng độ Zn²⁺ trong dung dịch là 1,1 M thì nồng độ H⁺ là 0,8 M.
c) Tại điện cực dương xảy ra quá trình khử ion H⁺ (aq) thành khí H₂.
d) Phản ứng xảy ra trong pin là H₂(s) + Zn²⁺(aq) → Zn(s) + 2H⁺(aq).
Câu 2. Cellulose là polymer thiên nhiên, có công thức phân tử (C₆H₁₀O₅)n, được cấu tạo như sau: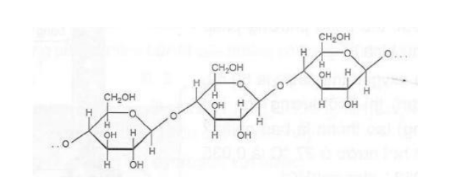 Cellulose được sử dụng làm vật liệu xây dựng (các loại đồ gỗ), sản xuất giấy, sợi tự nhiên và sợi nhân tạo. Cellulose cũng được sử dụng làm nguyên liệu để điều chế ethanol và cellulose trinitrate (dùng để chế tạo thuốc súng không khói).
Cellulose được sử dụng làm vật liệu xây dựng (các loại đồ gỗ), sản xuất giấy, sợi tự nhiên và sợi nhân tạo. Cellulose cũng được sử dụng làm nguyên liệu để điều chế ethanol và cellulose trinitrate (dùng để chế tạo thuốc súng không khói).
a) Trong cellulose, mỗi đơn vị C₆H₁₀O₅ có 3 nhóm -OH nên có thể viết công thức của cellulose là [C₆H₇O₂(OH)₃]n
b) Phân tử cellulose cấu tạo từ nhiều đơn vị α-glucose qua liên kết α-1,4-glycoside
c) Từ cellulose điều chế ethanol dựa vào tính chất lên men của cellulose và diễn ra 3 phản ứng hóa học.
d) Từ 1 tấn vụn gỗ điều chế được a kilogam cellulose trinitrate cần V lít dung dịch HNO₃ 63%. Biết vụn gỗ chứa 60% cellulose còn lại là tạp chất trơ, hiệu suất phản ứng 90%, dung dịch HNO₃ có khối lượng riêng bằng 1,4 gam/mL. Tổng giá trị (a + V) là 1784. (Làm tròn kết quả đến hàng đơn vị).
Câu 3. Geraniol là một thành phần hương liệu phổ biến, có hương hoa hồng và có thể tìm thấy trong tinh dầu hoa hồng và một số thực vật khác. Công thức của geraniol như sau: a) Công thức phân tử geraniol có dạng CnH₂n-2OH.
a) Công thức phân tử geraniol có dạng CnH₂n-2OH.
b) Tên của geraniol là cis-3,7-dimethylocta-2,6-dien-1-ol.
c) Geraniol là alcohol thơm, đơn chức.
d) Geranyl acetate là ester được điều chế từ geraniol theo sơ đồ phản ứng sau: Mỗi một chai nước hoa cỡ nhỏ (size S) với kích cỡ 50,0 ml có chứa 80% về thể tích geranyl acetate. Biết khối lượng riêng của geranyl acetate là 0,916 g/mL. Để điều chế 2940000 chai nước hoa size S cần 54,96 tấn acetic acid (hiệu suất phản ứng 60%).
Mỗi một chai nước hoa cỡ nhỏ (size S) với kích cỡ 50,0 ml có chứa 80% về thể tích geranyl acetate. Biết khối lượng riêng của geranyl acetate là 0,916 g/mL. Để điều chế 2940000 chai nước hoa size S cần 54,96 tấn acetic acid (hiệu suất phản ứng 60%).
Câu 4. Trong công nghiệp, nhôm được điều chế bằng cách điện phân nóng chảy hỗn hợp alumina (Al₂O₃) và cryolite (Na₃AlF₆) còn gọi là quy trình Hall–Héroult: 2Al₂O₃(l) → 4Al(l) + 3O₂(g) như hình dưới đây.
a) Nhôm kim loại được tách ra tại cathode.
b) Cryolite được thêm vào bể điện phân giúp tiết kiệm được năng lượng, giảm chi phí sản xuất.
c) Quy trình Hall–Héroult thu được nhôm tinh khiết và oxygen tinh khiết.
d) Trong quá trình điện phân, nếu đổi chiều dòng điện (anode trở thành cathode và ngược lại) thì quá trình điện phân vẫn xảy ra như trước khi đổi chiều dòng điện.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
Câu 1. Tại một nhà máy, quặng bauxite được đun nóng với dung dịch NaOH 32% ở nhiệt độ 170°C – 180°C để chuyển hóa Al₂O₃ thành muối dễ tan theo phương trình hóa học:
Al₂O₃ + 2NaOH → 2NaAlO₂ + H₂O
Để hòa tan hết Al₂O₃ có trong 1,5 tấn quặng bauxite (chứa 60% Al₂O₃ theo khối lượng) cần dùng bao nhiêu tấn dung dịch NaOH 32%? (làm tròn kết quả đến hàng phần mười).
Câu 2. Để làm nước phụ từ đậu tương, ban đầu người ta xay đậu tương với nước lọc và đun sôi. Sau đó, thêm nước chua vào dung dịch nước đậu tương đã được nấu chín, khi đó “óc đậu” sẽ bị kết tủa. Sau khi trải qua quá trình lọc, ép, chế biến, sẽ thu được thành phẩm đậu phụ. Nước chua có thể làm từ nước đậu phụ lên men hoặc giấm ăn. Để thu hồi đậu phụ nhanh và mịn, thay vì dùng nước chua để làm óc đậu, người ta có thể sử dụng thạch cao với hàm lượng an toàn với sức khỏe là không quá 1 g/1 kg đậu phụ.
Cho các nhận xét sau:
(a) Nước chua có tính acid nên làm protein trong nước đậu bị đông tụ.
(b) Thành phần chính của thạch cao là calcium carbonate.
(c) Bản chất sự tạo thành “óc đậu” từ nước đậu có quá trình đông tụ protein.
(d) Nếu hàm lượng thạch cao vượt ngưỡng 1 g/1 kg đậu phụ thì ảnh hưởng không tốt đến sức khỏe người tiêu dùng.
Có bao nhiêu nhận xét đúng?
Câu 3. Theo các tài liệu được công bố, đường huyết lúc đói (với người không ăn gì ít nhất 8 tiếng) sẽ được coi là nguy hiểm khi cao hơn 0,130 gam glucose/100 mL, máu ở người bệnh tiểu đường và vượt quá mức 100 mg/dL ở người không mắc bệnh. Lượng đường glucose trong máu của anh X là 0,140 gam glucose/100 mL máu. Khi anh X uống dung dịch chứa 2,0 gam glucose, lượng đường trong máu sẽ tăng lên. Giả sử toàn bộ lượng đường này được hấp thụ vào máu và tổng thể tích máu trong cơ thể anh X không đổi là 5,0 L. Cho các phát biểu sau:
(1) Lượng đường trong máu của anh X đang ở mức nguy hiểm.
(2) Tổng khối lượng glucose trong cơ thể anh X trước khi hấp thụ glucose là 6,5 gam.
(3) Tổng khối lượng glucose trong cơ thể anh X sau khi hấp thụ glucose là 7,4 gam.
(4) Đường huyết trong máu anh X sau khi hấp thụ là 0,180 gam glucose/100 mL máu.
Các phát biểu đúng xếp theo trình tự tăng dần là (ví dụ 1234, 234, 34, 4,…)
Câu 4. Thuỷ phân không hoàn toàn pentapeptide Gly-Ala-Gly-Ala-Val thì thu được tối đa bao nhiêu dipeptide khác nhau?
Câu 5. Lactic acid hay acid sữa là hợp chất hóa học đóng vai trò quan trọng trong nhiều quá trình sinh hóa, lần đầu tiên được phân tách vào năm 1780 bởi nhà hóa học Thụy Điển Carl Wilhelm Scheele. Lactic acid có công thức phân tử C₃H₆O₃, công thức cấu tạo: CH₃-CH(OH)-COOH. Khi vận động mạnh cơ thể không đủ cung cấp oxygen, thì cơ thể sẽ chuyển hóa glucose thành lactic acid từ các tế bào để cung cấp năng lượng cho cơ thể theo phương trình sau:
C₆H₁₂O₆(aq) → 2C₃H₆O₃(aq) ΔrH⁰₂₉₈ = – 150 kJ
Biết rằng cơ thể chỉ cung cấp 98% năng lượng từ quá trình oxi hóa glucose bằng oxygen, năng lượng còn lại nhờ vào sự chuyển hóa glucose thành lactic acid. Giả sử một người chạy bộ trong một thời gian tiêu tốn 250 kcal. Tính khối lượng lactic acid tạo ra từ quá trình chuyển hóa đó. Biết 1 cal = 4,184 J (kết quả được làm tròn đến chữ số hàng phần mười).
Câu 6. Một nhà máy chuyên sản xuất thép (chứa 1% C theo khối lượng) với công nghệ lò luyện thép Martin. Sơ đồ phản ứng luyện thép trong lò là Fe₃O₄ + C → Fe + CO₂. Nguyên liệu nhà máy trên sử dụng để luyện thép gồm sắt phế liệu (chứa 50% Fe₃O₄; 49% Fe; 1% C theo khối lượng) và gang (chứa 4% khối lượng C còn lại là Fe). Một mẻ luyện thép cần 5 tấn gang và m tấn sắt phế liệu (hiệu suất của quá trình là 100%). Tính giá trị m. (kết quả được làm tròn đến hàng đơn vị).
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ vào các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục tiêu chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Sử dụng kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh cho các trường đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương cũng như trên cả nước, từ đó làm cơ sở điều chỉnh nội dung và phương pháp dạy học trong nhà trường.
Thí sinh thi Tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 bắt buộc phải thi 3 môn: Toán, Ngữ văn và Ngoại ngữ.
Bên cạnh đó, thí sinh lựa chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí, Giáo dục công dân (đối với học sinh học chương trình GDPT).
Môn Hóa học là một trong ba môn thành phần của bài thi tổ hợp KHTN. Việc thi môn Hóa học không bắt buộc nếu thí sinh không chọn tổ hợp KHTN, trừ khi môn này được sử dụng để xét tốt nghiệp hoặc phục vụ xét tuyển vào các ngành học yêu cầu Hóa học.
Chính vì vậy, “Đề thi tốt nghiệp THPT 2025 môn Hóa học – Bám sát đề minh họa – Đề 9” là tài liệu ôn tập cần thiết dành cho thí sinh chọn bài thi tổ hợp KHTN. Bộ đề được xây dựng bám sát cấu trúc và nội dung đề minh họa của Bộ GD&ĐT, giúp học sinh củng cố kiến thức, luyện tập kỹ năng làm bài và nâng cao sự tự tin trước kỳ thi quan trọng.




