Đề thi thử Đại học 2025 môn Hóa học – Chuyên KHTN Hà Nội (Lần 1) là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT. Đây là tài liệu giá trị dành cho học sinh lớp 12 đang ôn luyện giai đoạn nước rút trước kỳ thi quan trọng nhất trong năm.
Là đề thi đến từ Trường THPT Chuyên Khoa học Tự nhiên – Đại học Quốc gia Hà Nội, một trong những cái nôi đào tạo học sinh giỏi hàng đầu cả nước, đề thi này nổi bật với mức độ phân hóa sâu, tư duy logic cao và bám sát form đề minh họa THPT 2025 của Bộ GD&ĐT. Nội dung đề trải rộng toàn bộ chương trình Hóa học 12, tập trung vào các chuyên đề quan trọng như: este – lipit, amin – amino axit – protein, kim loại – phản ứng điện hóa – điện phân, bài toán đồ thị – thí nghiệm, và nhận biết hóa chất – phản ứng đặc trưng. Đặc biệt, đề có nhiều câu hỏi dạng mới, đòi hỏi học sinh phải tư duy tổng hợp, phân tích kỹ dữ kiện và lựa chọn chiến lược giải hợp lý.
Hãy cùng Dethitracnghiem.vn khám phá ngay đề thi mang tính phân loại cao này và chinh phục từng câu hỏi để sẵn sàng bứt phá điểm số trong kỳ thi THPT Quốc gia 2025!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 CHUYÊN KHTN HÀ NỘI (LẦN 1)

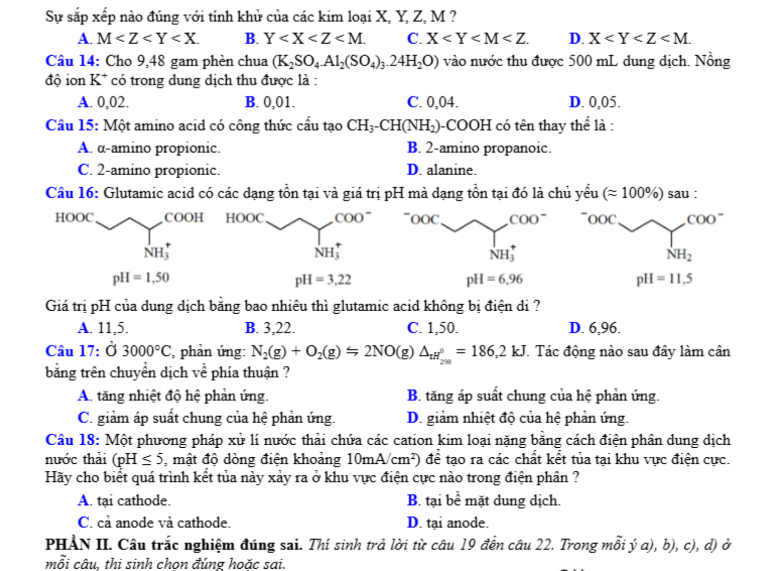



Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi chỉ có một phương án lựa chọn.
Câu 1: Cho biết: E⁰Al³⁺/Al = -1,676V; E⁰Fe²⁺/Fe = -0,440V; E⁰Cu²⁺/Cu = +0,340V. Sự sắp xếp nào đúng với tính oxi hóa của các cation Al³⁺, Fe²⁺ và Cu²⁺?
A. Cu²⁺ > Fe²⁺ > Al³⁺.
B. Fe²⁺ > Cu²⁺ > Al³⁺.
C. Cu²⁺ > Al³⁺ > Fe²⁺.
D. Al³⁺ > Fe²⁺ > Cu²⁺.
Câu 2: Năng lượng hóa học của một số phản ứng được ghi ở các sơ đồ dưới đây: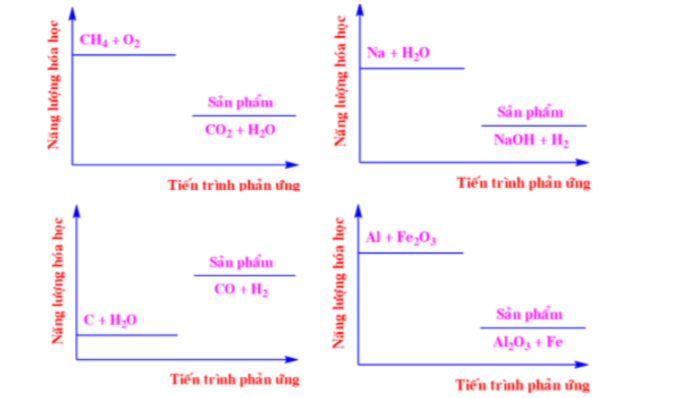
Số phản ứng tỏa nhiệt là
A. 2.
B. 4.
C. 1.
D. 3.
Câu 3: Khi cho khí chlorine vào dung dịch KI dư thì thu được dung dịch X. Nhỏ vài giọt hồ tinh bột vào dung dịch X thì dung dịch chuyển màu gì?
A. Vàng lục.
B. Xanh tím.
C. Tím đen.
D. Đỏ nâu.
Câu 4: Cho sơ đồ phản ứng sau:
2-Chlorobutane — +NaOH/rượu→X — +H₂O/H₃PO₄, t°→Y
Trong đó: X là sản phẩm chính của phản ứng. Chất Y là
A. CH₃CH₂CH₂CH₂OH.
B. (CH₃)₂COH và (CH₃)₂CHCH₂OH.
C. CH₃CH₂CH(OH)CH₃ và CH₂CH₂CH₂CH₂OH.
D. CH₃CH₂CH(OH)CH₃.
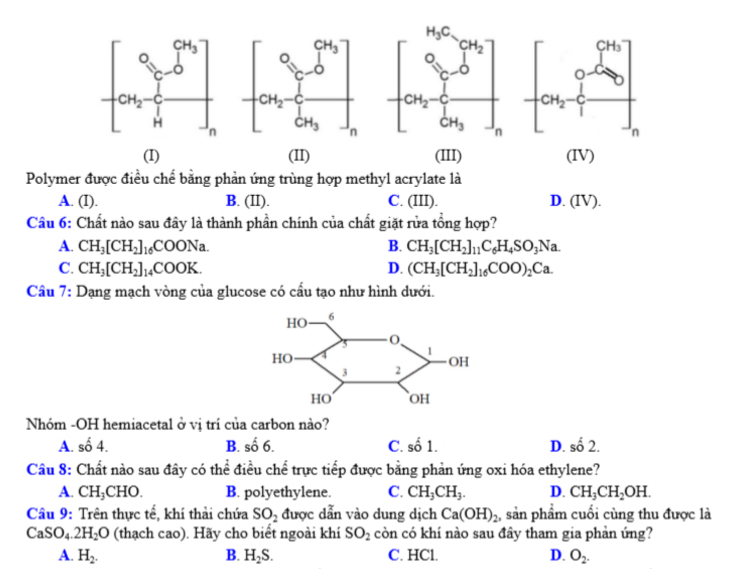
Câu 5: Cho các polymer sau: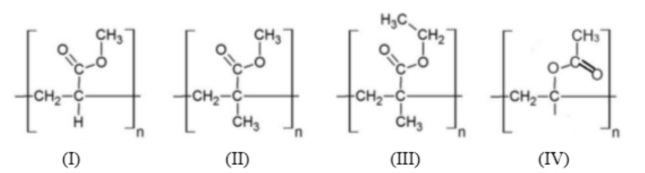
Polymer được điều chế bằng phản ứng trùng hợp methyl acrylate là
A. (I).
B. (II).
C. (III).
D. (IV).
Câu 6: Chất nào sau đây là thành phần chính của chất giặt rửa tổng hợp?
A. CH₃[CH₂]₂COONa.
B. CH₃[CH₂]₁₂C₆H₄SO₃Na.
C. CH₃[CH₂]₁₄COOK.
D. CH₃[CH₂]₁₅(COO)₂Ca.
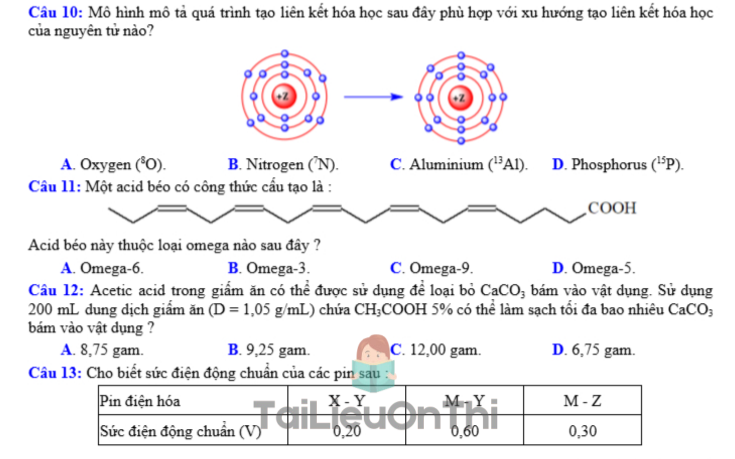
Câu 7: Dạng mạch vòng của glucose có cấu tạo như hình dưới.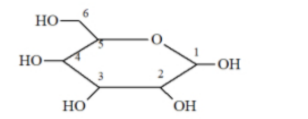
Nhóm -OH hemiacetal ở vị trí của carbon nào?
A. số 4.
B. số 6.
C. số 1.
D. số 2.
Câu 8: Chất nào sau đây có thể điều chế trực tiếp bằng phản ứng oxi hóa ethylene?
A. CH₃CHO.
B. CH₃-CH₃.
C. CH₂CH₂OH.
D. CH₂=CH₂OH.
Câu 9: Trên thực tế, khi thải chua SO₂, được dẫn vào dung dịch Ca(OH)₂ sản phẩm cuối cùng thu được là CaSO₄.2H₂O (thạch cao). Hãy cho biết ngoài khí SO₂ còn có khí nào sau đây tham gia phản ứng?
A. H₂.
B. H₂S.
C. HCl.
D. O₂.
Câu 10: Mô hình mô tả quá trình tạo liên kết hóa học sau đây phù hợp với xu hướng tạo liên kết hóa học của nguyên tử nào?
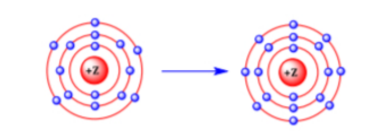
A. Oxygen (⁸O).
B. Nitrogen (⁷N).
C. Aluminium (¹³Al).
D. Phosphorus (¹⁵P).
Câu 11: Một acid béo có công thức cấu tạo là: ![]()
Acid béo này thuộc loại omega nào sau đây ?
A. Omega-6.
B. Omega-3.
C. Omega-9.
D. Omega-5.
Câu 12: Acetic acid trong giấm ăn có thể được sử dụng để loại bỏ CaCO₃ bám vào vật dụng. Sử dụng 200 mL dung dịch giấm ăn (D = 1,05 g/mL) chứa CH₃COOH 5% có thể làm sạch tối đa bao nhiêu CaCO₃ bám vào vật dụng ?
A. 8,75 gam.
B. 9,25 gam.
C. 12,00 gam.
D. 6,75 gam.
Câu 13: Cho biết sức điện động chuẩn của các pin sau
Sự sắp xếp nào sau đây đúng với tính khử của các kim loại X, Y, Z, M ?
A. Y < X < Z < M.
B. Y < X < M < Z.
C. M < Z < Y < X.
D. X < Y < Z < M.
Câu 14: Cho 9,48 gam phèn chua (K₂SO₄.Al₂(SO₄)₃.24H₂O) vào nước thu được 500 mL dung dịch. Nồng độ ion K⁺ trong dung dịch thu được là:
A. 0,02.
B. 0,01.
C. 0,04.
D. 0,05.
Câu 15: Một amino acid có công thức cấu tạo CH₃-CH(NH₂)-COOH có tên thay thế là :
A. -amino propionic.
B. 2-amino propanoic.
C. 2-amino propionic.
D. alanine.
Câu 16: Glutamic acid có các dạng tồn tại và giá trị pH mà dạng tồn tại đó là chủ yếu (≈100%) sau :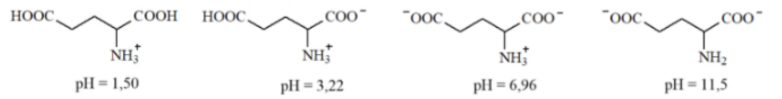
Giá trị pH của dung dịch bằng bao nhiêu thì glutamic acid không bị điện di ?
A. 11,5.
B. 3,22.
C. 1,50.
D. 6,96.
Câu 17: Ở 3000°C, phản ứng: N₂(g) + O₂(g) ⇌ 2NO(g). \(\Delta_r H_{298}^\circ = 186,2\ \text{kJ}\)
Tác động nào sau đây làm cân bằng chuyển dịch về phía thuận?
A. tăng nhiệt độ hệ phản ứng.
B. tăng áp suất chung của hệ phản ứng.
C. giảm áp suất chung của hệ phản ứng.
D. giảm nhiệt độ của hệ phản ứng.
Câu 18: Một phương pháp xử lí nước thải chứa các cation kim loại nặng bằng cách điện phân dung dịch nước thải (pH≤5, mật độ dòng điện 10mA/cm²) để tạo ra các chất kết tủa tại khu vực điện cực. Hãy cho biết quá trình kết tủa này xảy ra ở khu vực điện cực nào trong điện phân?
A. tại cathode.
B. tại bề mặt dung dịch.
C. cả anode và cathode.
D. tại anode.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chỉ chọn đúng hoặc sai.
Câu 19: Salbutamol là một hợp chất hữu cơ có hoạt tính sinh học cao. Bên cạnh tác dụng chính dùng trong y học, salbutamol còn sử dụng làm doping trong thi đấu thể thao. Trong thi đấu thể thao vận động viên sử dụng salbutamol với liều lượng vượt quá 20 µg/kg trong vòng 24h được coi là sử dụng doping (Tổ chức phòng chống Doping thế giới, WADA). Salbutamol có công thức cấu tạo như hình bên.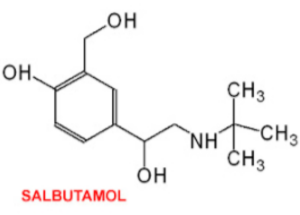
Salbutamol có những tính chất hóa học đặc trưng như sau: 2 nhóm -OH liên kết trực tiếp với nguyên tử carbon no (nhóm chức -OH alcohol) và 1 nhóm -OH liên kết trực tiếp với nguyên tử carbon của vòng benzene (nhóm chức -OH phenol). Sự khác biệt của hai loại nhóm chức này là nhóm -OH phenol có lực acid mạnh hơn nhóm -OH alcohol, chúng đều phản ứng với Na kim loại và sản phẩm là sodium alcoholate và sodium phenolate, nhưng phenol còn có khả năng phản ứng với dung dịch NaOH còn alcohol không có phản ứng này. Một tính chất khác biệt nữa đó là nhóm -OH alcohol có khả năng bị thay thế với nguyên tử bromine (Br) khi cho tác dụng với acid HBr mà nhóm -OH phenol không có tính chất này. Ngoài ra, cấu tạo của salbutamol còn có một nhóm amine bậc 2 (R-NH-R’ trong đó R và R’ là các gốc hydrocarbon) mang tính chất hóa học của một base, có khả năng tạo muối R(R’)NH₂Br khi cho tác dụng với acid HBr.
a) Salbutamol tác dụng với NaOH theo tỉ lệ mol 1 : 1.
b) Một vận động viên thể thao có cân nặng 80 kg thì trong vòng 24h chỉ được sử dụng tối đa là 1600 µg salbutamol?
c) Khi cho salbutamol tác dụng với HBr dư thu được hợp chất có công thức phân tử là C₁₂H₂₂NO₃Br
d) Salbutamol tác dụng với Na theo tỉ lệ mol 1 : 3.
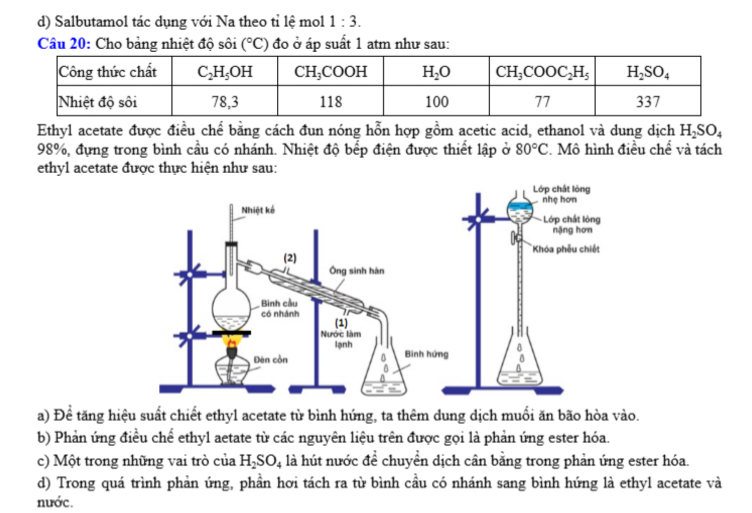
Câu 20: Cho bảng nhiệt độ sôi (°C) đo ở áp suất 1 atm như sau: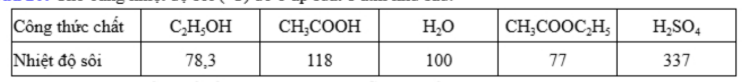
Ethyl acetate được điều chế bằng cách đun nóng hỗn hợp gồm acetic acid, ethanol và dung dịch H₂SO₄ 98%, đựng trong bình cầu có nhánh. Nhiệt độ bếp điện được thiết lập ở 80°C. Mô hình điều chế và tách ethyl acetate được thực hiện như sau: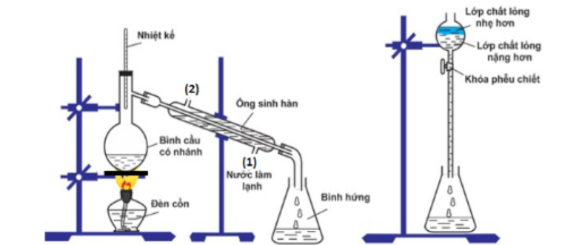
a) Để tăng hiệu suất chiết ethyl acetate từ bình hứng, ta thêm dung dịch muối ăn bão hòa vào.
b) Phản ứng điều chế ethyl acetate từ các nguyên liệu trên được gọi là phản ứng ester hóa.
c) Một trong những vai trò của H₂SO₄ là hút nước để chuyển dịch cân bằng trong phản ứng ester hóa.
d) Trong quá trình phản ứng, phần hơi tách ra từ bình cầu có nhánh sang bình hứng chủ yếu là ethyl acetate và nước.
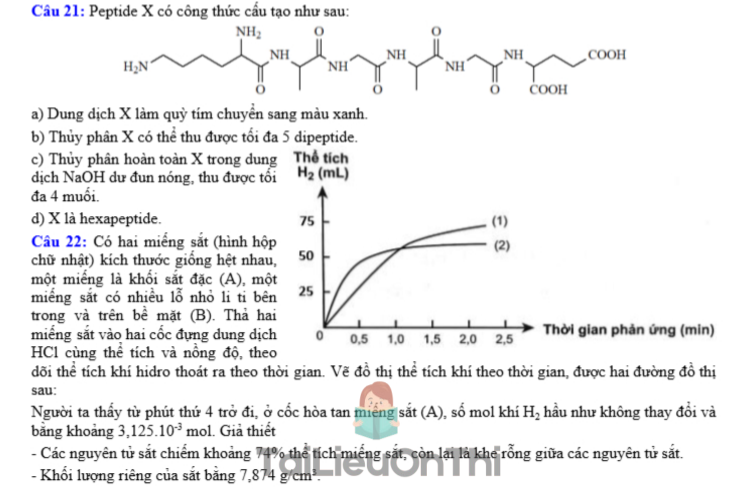
Câu 21: Peptide X có công thức cấu tạo như sau: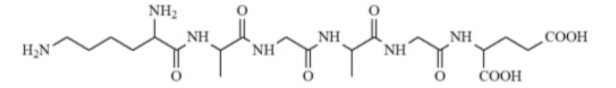
a) Dung dịch X làm quỳ tím chuyển sang màu xanh.
b) Thủy phân X có thể thu được tối đa 5 dipeptide.
c) Thủy phân hoàn toàn X trong dung dịch NaOH đun nóng, thu được tối đa 4 muối.
d) X là hexapeptide.
Câu 22: Có hai miếng sắt (hình hộp chữ nhật) kích thước giống hệt nhau, một miếng là khối sắt đặc (A), một miếng sắt có nhiều lỗ nhỏ li ti bên trong và trên bề mặt (B). Thả hai miếng sắt vào hai cốc dung dịch HCl cùng thể tích và nồng độ, theo dõi thể tích khí hidro thoát ra theo thời gian. Vẽ đồ thị thể tích khí theo thời gian, được hai đường đồ thị sau: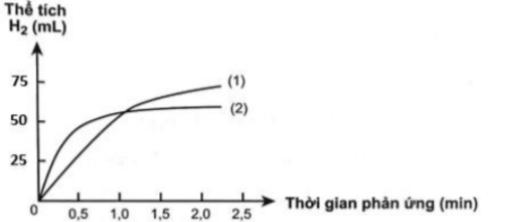
Người ta thấy từ phút thứ 4 trở đi, ở cốc hòa tan miếng sắt (A), số mol H₂ hầu như không thay đổi và bằng khoảng 3,125.10⁻³ mol. Giả thiết
– Các nguyên tử sắt chiếm khoảng 74% thể tích miếng sắt, còn lại là thể rỗng giữa các nguyên tử sắt.
– Khối lượng riêng của sắt bằng 7,874 g/cm³.
– Diện tích của miếng sắt (A) bằng 0,4 cm².
Coi nguyên tử sắt là hình cầu bán kính R với thể tích Vcầu = (4/3)R³ với ≈ 3,14 và N= 6,02.10²³.
a) Bề dày của miếng sắt (A) bằng 0,056 (cm) (làm tròn đến hàng phần nghìn).
b) Đường cong số (1) mô tả tốc độ thoát khí từ miếng sắt (A).
c) Đường cong số (2) mô tả tốc độ thoát khí từ miếng sắt (B).
d) Bán kính nguyên tử sắt 1,28Å.
PHẦN III. Câu hỏi trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
Câu 23: Ethanol có thể được sản xuất từ cellulose. Loại ethanol này được dùng để sản xuất xăng E₅ (chứa 5% ethanol về thể tích). Ethanol thu được từ 1 tấn mùn cưa (chứa 50% cellulose, phần còn lại là chất trơ) có thể dùng để pha chế bao nhiêu L xăng E₅? Biết hiệu suất quá trình sản xuất ethanol từ cellulose là 60% và ethanol có khối lượng riêng là 0,8 g/mL. (Làm tròn kết quả đến hàng đơn vị)
Câu 24: Nhôm (Aluminium) được sản xuất bằng phương pháp điện phân Al₂O₃ tinh khiết. Quặng nhôm thường chứa thạch anh, silicate (chứa Si) và một số tạp chất khác cần được loại bỏ. Một loại quặng bauxite gồm Al₂O₃.3H₂O và 10,0 % kaolin Al₂Si₂O₅.2H₂O được dùng để sản xuất nhôm theo quy trình Bayer. Tính tỉ lệ hao hụt của nhôm trong quá trình tinh chế, biết silic thường được loại bỏ ở dạng bùn aluminosilicat (Na₆Al₆Si₆O₂₂.5H₂O). (Làm tròn kết quả đến hàng phần trăm)
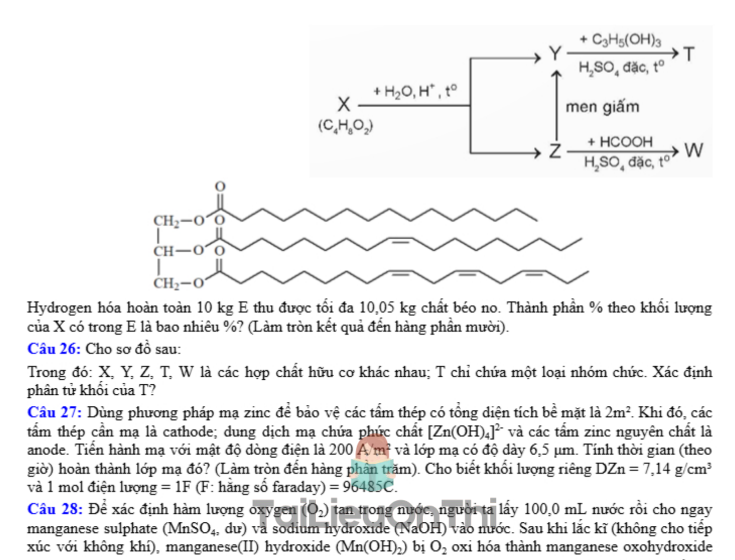
Câu 25: Hydrogen hóa chất béo lỏng để thành chất béo rắn là quá trình phá vỡ các liên kết C=C để chuyển thành các liên kết C-C. Chất béo E có chứa X (cấu tạo hình dưới) và các triglyceride no.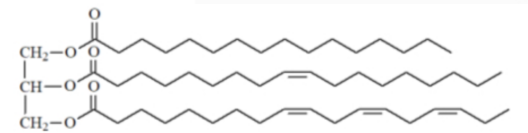
Hydrogen hóa hoàn toàn 10 kg E thu được tối đa 10,05 kg chất béo no. Thành phần % theo khối lượng của X có trong E là bao nhiêu %? (Làm tròn kết quả đến hàng phần mười).
Câu 26: Cho sơ đồ sau: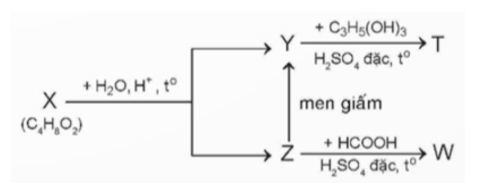
Trong đó: X, Y, Z, T, W là các hợp chất hữu cơ khác nhau; T chỉ chứa một loại nhóm chức. Xác định phân tử khối của T?
Câu 27: Điện phân phương pháp mạ zinc để bảo vệ các tấm thép có tổng diện tích bề mặt là 2m². Khi đó, các tấm thép cần mạ là cathode; dung dịch mạ chứa phức chất [Zn(OH)₄]²⁻ và các tấm zinc nguyên chất là anode. Tiến hành mạ với mật độ dòng điện 200 A/m² và lớp mạ có độ dày 6,5
m. Tính thời gian (theo giờ) hoàn thành lớp mạ đó? (Làm tròn đến hàng phần trăm). Cho biết khối lượng riêng Dzn = 7,14 g/cm³ và 1 mol điện lượng = 1F (F: hằng số faraday) = 96485C.
Câu 28: Để xác định hàm lượng oxygen (O₂) tan trong nước người ta lấy 100,0 mL nước rồi cho ngay manganese sulphate (MnSO₄, dư) và sodium hydroxide (NaOH) vào nước. Sau khi lắc kĩ (không cho tiếp xúc với không khí), manganese(II) hydroxide (Mn(OH)₂) bị O₂ oxi hóa thành manganese oxohydroxide (MnO(OH)₂). Thêm acid (dư) và cho tiếp potassium iodide (KI, dư) vào hỗn hợp, thì ion iodine (I) bị MnO(OH)₂ oxi hóa thành iodine (I₂). Lượng I₂ sinh ra phản ứng vừa đủ với 10,5 ml dung dịch Na₂S₂O₃ 0,01M (sodium thiosulphate). Biết các phản ứng xảy ra như sau:
Mn²⁺ + OH⁻ → Mn(OH)₂(1)
Mn(OH)₂ + O₂ → MnO(OH)₂(2)
MnO(OH)₂ + I⁻ + H⁺ → Mn²⁺ + I₂ + H₂O (3)
I₂ + Na₂S₂O₃ → Na₂S₄O₆ + NaI (4)
Hàm lượng O₂ tan trong nước (tính theo mg O₂/1L) là a. Giá trị của a là bao nhiêu? (Làm tròn kết quả đến hàng phần mười)
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




