Đề thi thử Đại học 2025 môn Hóa học – Sở GDĐT Long An là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, trong chương trình Đề thi vào Đại học.
Đề thi được xây dựng bám sát cấu trúc và nội dung đề minh họa 2025 của Bộ GD&ĐT, tập trung vào các chuyên đề quan trọng như: Este – Lipit, Amin – Amino axit, Cacbohiđrat, Kim loại, Phi kim và Hóa học đại cương. Với độ phân hóa rõ ràng, đề không chỉ kiểm tra kiến thức cơ bản mà còn giúp học sinh luyện tập tư duy phân tích và phản xạ nhanh.
Hãy cùng Dethitracnghiem.vn chinh phục đề thi này để nâng cao kỹ năng và sẵn sàng cho kỳ thi THPT Quốc gia 2025!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GDĐT LONG AN




Cho các giá trị thế điện cực chuẩn: E°Ag⁺/Ag = 0,799V; E°Li⁺/Li = -3,05V; E°Mg²⁺/Mg = -2,37V; E°Zn²⁺/Zn = -0,762V; E°Sn²⁺/Sn = -0,44V; E°Cu²⁺/Cu = 0,34V; E°Sn²⁺/Sn = -0,14V; E°H⁺/H₂ = 0V.
Cho khối lượng mol của: H=1; C=12; N=14; O=16; S=32; Ca=40; Fe=56; Br=80.
PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Polyethylene được trùng hợp từ monomer nào?
A. CH₂=CH₂.
B. CH₃-CH₃.
C. CH₂=CH-CN.
D. C₆H₅-CH=CH₂.
Câu 2. Propene tác dụng với dung dịch HBr tạo ra hai dẫn xuất bromo là CH₃ – CHBr – CH₃ (sản phẩm chính) và CH₃ – CH₂ – CH₂Br (rất ít). Giai đoạn (1) trong cơ chế phản ứng này có sự tạo thành các tiểu phân trung gian là carbocation I và carbocation II như sau:
CH₃ – CH = CH₂ + H⁺ → CH₃ – CH – CH₃ (carbocation I)
CH₃ – CH = CH₂ + H⁺ → CH₃ – CH₂ – CH₂ (carbocation II)
Trong giai đoạn (1) này, CH₃ – CH = CH₂ là chất phản ứng, H⁺ là tác nhân. Ở giai đoạn (2), ion Br⁻ sẽ kết hợp với các tiểu phân trung gian tạo thành sản phẩm.
Phát biểu nào dưới đây đúng?
A. Trong giai đoạn (1), khi phản cắt liên kết π, cặp electron được chia đều cho mỗi nguyên tử carbon.
B. Ion H⁺ là tác nhân giàu electron, có khả năng nhường electron cho liên kết π.
C. Carbocation I bền hơn carbocation II.
D. Ở giai đoạn (2), ion Br⁻ chỉ kết hợp với carbocation I mà không kết hợp được với carbocation II.
Câu 3. Nguyên tố Na thuộc nhóm IA. Kim loại Na được bảo quản bằng cách ngâm trong chất lỏng nào dưới đây?
A. Dầu hỏa.
B. Nước cất.
C. Acetic acid.
D. Ethanol.
Câu 4. Công thức cấu tạo thu gọn của methylamine là
A. CH₃NH₂.
B. CH₃NHCH₃.
C. CH₃NHCH₂.
D. CH₂NH₂.
Câu 5. Kết quả phân tích phổ khối lượng (MS) của một hydrocarbon X cho biết phân tử khối của nó là 58. X có công thức phân tử là
A. C₄H₁₀.
B. C₄H₈.
C. C₄H₆.
D. C₅H₁₂.
Câu 6. Lysine đóng vai trò chính trong quá trình tổng hợp protein, sản xuất hormone,… Với mỗi môi trường có giá trị pH bằng 2,2; 10,5; 11,5, coi lysine chỉ tồn tại ở dạng cho dãy: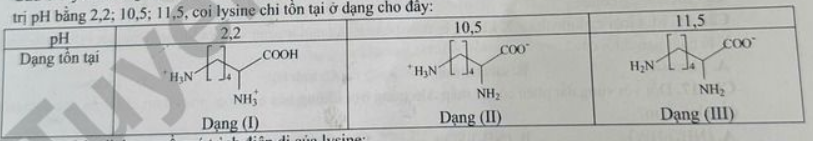
Cho các nhận định sau về quá trình điện di của lysine:
(a) Với môi trường pH = 2,2 thì dạng (I) di chuyển về phía cực âm.
(b) Với môi trường pH = 10,5 thì dạng (II) hầu như không di chuyển về các điện cực.
(c) Với môi trường pH = 11,5 thì dạng (III) di chuyển về phía cực dương.
(d) Với môi trường pH = 10,5 thì dạng (II) di chuyển về phía cực âm.
Số nhận định đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 7. Cho các phát biểu sau:
(1) Trong dung dịch, C₂H₅NH₂ phản ứng với nước tạo ra ion C₂H₅NH₃⁺ và ion OH⁻.
(2) Khi cho ethylamine phản ứng với dung dịch FeCl₃ sẽ cho kết tủa nâu đỏ.
(3) Aniline có tính base và làm quỳ tím ẩm chuyển màu.
(4) Tính base methylamine mạnh hơn ethylamine.
Các phát biểu đúng là
A. (1), (2).
B. (1), (4).
C. (1), (2), (3).
D. (2), (3), (4).
Câu 8. Tên gọi của ester CH₃COOCH₃ là
A. ethyl acetate.
B. methyl propionate.
C. ethyl formate.
D. methyl acetate.
Câu 9. Điểm chảy chảy là nhiệt độ thấp nhất mà một chất lỏng hoặc vật liệu dẻo hay hơi tạo thành lượng hơi đủ để chảy. Nhiệt độ nóng chảy là nhiệt độ mà tại đó chất chảy từ bốc cháy rắn không cần nguồn lửa. Nhiệt độ tự bốc cháy là nhiệt độ cao nhất có thể tạo ra bởi chất chảy. Áp suất bốc chảy áp suất khí quyển là -22°C, nhiệt độ bốc cháy là 239°C và nhiệt độ nóng chảy là 2040°C. Cho các phát biểu dưới đây (ở áp suất khí quyển):
(a) Hexane là chất lỏng.
(b) Ở 100°C, hexane tự bốc cháy mà không cần nguồn lửa.
(c) Có thể dùng hexane để nấu chảy chì (lead), nhiệt độ nóng chảy là 328°C.
(d) Khi xảy ra đám cháy xăng hexane, thường dùng H₂O để dập tắt.
Trong các phát biểu trên, có bao nhiêu phát biểu đúng?
A. 3.
B. 2.
C. 1.
D. 4.
Câu 10. Chất nào dưới đây là chất béo?
A. (C₁₇H₃₅COO)₃C₃H₅.
B. C₁₇H₃₅COOH.
C. (C₁₅H₃₁COO)₃C₃H₅.
D. (CH₃COO)₃C₃H₅.
Câu 11. Ở điều kiện chuẩn, ion kim loại Fe³⁺ khử được ion kim loại nào sau đây?
A. Ag⁺.
B. Mg²⁺.
C. Li⁺.
D. Zn²⁺.
Câu 12. Phương pháp nào dưới đây không làm mềm nước cứng có tính cứng tạm thời?
A. Dùng vữa đá Ca(OH)₂.
B. Đun sôi.
C. Dùng vữa đá Na₂CO₃.
D. Dùng dung dịch HCl.
Câu 13. Trong số các kim loại gồm Li, Mg, Zn và Ag, ở điều kiện chuẩn kim loại nào có tính khử mạnh nhất?
A. Zn.
B. Li.
C. Mg.
D. Ag.
Câu 14. Dây cháy, thường làm bằng chì (lead, kí hiệu Pb), là một chi tiết trong cầu chì. Khi có sự cố xảy ra làm tăng nhiệt độ, dây cháy bị đứt và ngăn dòng điện, bảo vệ các thiết bị điện. Kim loại chì (lead) được sử dụng làm dây cháy trong cầu chì chủ yếu là do tính chất nào dưới đây?
A. Độ cứng tương đối thấp.
B. Độ dẫn điện tương đối thấp.
C. Khối lượng riêng tương đối nhỏ.
D. Nhiệt độ nóng chảy tương đối thấp.
Câu 15. Đá vôi có thành phần chính là CaCO₃. Tên gọi của CaCO₃ là gì?
A. Sodium carbonate.
B. Sodium sulfate.
C. Calcium carbonate.
D. Calcium sulfate.
Câu 16. Một loại carbohydrate X không bị thủy phân trong môi trường acid và không làm mất màu nước bromine. X là chất nào dưới đây?
A. glucose.
B. saccharose.
C. tinh bột.
D. fructose.
Câu 17. Đối với vùng đất phèn có pH thấp, khi trồng trọt không nên bón loại phân đạm nào dưới đây để tránh làm đất chua hơn?
A. (NH₄)₂HPO₄.
B. (NH₄)₂SO₄.
C. KNO₃.
D. (NH₂)₂CO.
Câu 18. Trong công nghiệp, để tách kim loại Al khỏi hợp chất Al₂O₃ thì cần sử dụng phương pháp nào dưới đây?
A. Cho kim loại Na tác dụng với dung dịch AlCl₃.
B. Điện phân Al₂O₃ nóng chảy.
C. Điện phân dung dịch AlCl₃.
D. Nung Al₂O₃ với khí CO ở nhiệt độ 600°C.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d), ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Một học sinh tiến hành tổng hợp isoamyl acetate (thành phần chính của dầu chuối, khối lượng riêng 0,88 gam/mL) từ acetic acid và isoamyl alcohol với xúc tác H₂SO₄ đặc, ở nhiệt độ khoảng 145°C.
[Diagram showing experimental setup for esterification, distillation and collection of ester.]
Tiến hành cho vào bình cầu 5 mL isoamyl alcohol 90%, 6 mL acetic acid và vài giọt H₂SO₄ đặc làm xúc tác. Sau đó lắp ống sinh hàn và đun hỗn hợp ở khoảng 145°C trong 30-45 phút để phản ứng diễn ra. Khi phản ứng kết thúc, để nguội hỗn hợp rồi rót vào phễu chiết có chứa khoảng 10 mL nước cất. Tiến hành chiết để thu lấy isoamyl acetate theo mô hình thí nghiệm sau:
a) Bộ dụng cụ chiết (ước mờ ở hình trên) dùng để tách các chất lỏng không tan vào nhau.
b) isoamyl acetate là lớp chất lỏng nhẹ hơn và được thu sau cùng.
c) Phản ứng tổng hợp trong thí nghiệm trên là phản ứng ester hóa.
d) Chất lỏng sinh ra có chứa nhiều dẫn chứng trong bình hứng là isoamyl acetate.
Câu 2. Polyethylene terephthalate (hay còn gọi là PET) là một loại polymer có nhiều ứng dụng trong công nghiệp và đời sống như làm vỏ chai, hộp, vải may quần áo, rèm cửa, vỏ máy móc, linh kiện điện tử,… PET được điều chế từ terephthalic acid và ethylene glycol theo phản ứng:
n HOOC-C₆H₄-COOH + n HO-CH₂-CH₂-OH → (-OC-C₆H₄-CO-O-CH₂-CH₂-O-)n + (2n-1) H₂O
[Diagram showing formation of PET polymer]
a) Mỗi phân tử PET có phân tử khối là 192.
b) Phản ứng điều chế PET từ terephthalic acid và ethylene glycol là phản ứng trùng ngưng.
c) PET bền cả trong môi trường acid mạnh lẫn môi trường base mạnh.
d) Các mắt xích trong phân tử PET liên kết với nhau bởi nhóm chức ester.
Câu 3. Nguyên tố copper (Cu) có cấu hình electron nguyên tử là [Ar] 3d¹⁰ 4s¹. Trong tự nhiên có nhiều dạng copper như malachite (CuCO₃.Cu(OH)₂), chalcocite (Cu₂S),…
Nước Schweizer có khả năng hoà tan cellulose. Theo các phản ứng:
Cu(OH)₂ + 2NH₃ → Cu(NH₃)₄₂
Cu(OH)₂ + 4NH₃ → Cu(NH₃)₄₂
Cu(OH)₂ + 4NH₃ → [Cu(NH₃)₄]²⁺ + 2OH⁻
Cu(OH)₂ là chất rắn, màu xanh, không tan trong nước, ion [Cu(NH₃)₄]²⁺ (hydroxide tetramminecopper(II) ion) tồn tại trong dung dịch dưới dạng ion [Cu(NH₃)₄]²⁺ và ion OH⁻.
a) Khi cho từ từ H₂S vào dung dịch CuSO₄ thì ban đầu có kết tủa màu xanh, sau đó kết tủa tan khi H₂S dư.
b) Trong hợp chất, copper chỉ thể hiện mức oxi hoá +2.
c) Nước Schweizer chứa phức chất [Cu(NH₃)₄]²⁺ có các phối tử là NH₃ và OH⁻.
d) Copper là nguyên tố kim loại dãy chuyển tiếp thứ nhất.
Câu 4. Đường là lactic acid, phụ trong quá trình sản xuất và tinh luyện đường mía. Việc tận dụng rỉ đường làm môi trường nuôi cấy là giải pháp hiệu quả vừa giảm thiểu ô nhiễm môi trường và góp phần phát triển bền vững. Một nhóm học sinh đã nghiên cứu quá trình sử dụng vi khuẩn Lactobacillus để lên men rỉ đường tạo lactic acid ở nhiệt độ phòng với pH = 6,0. Giả thuyết được đưa ra là: “Với tỉ lệ rỉ đường càng cao (hàm lượng glucose càng lớn), lượng lactic acid thu được càng nhiều.”
Thí nghiệm được tiến hành như sau:
Chuẩn bị dung dịch rỉ đường với các nồng độ: 5%, 10%, 15% và 20%. Mỗi mẫu được bổ sung 10% vi khuẩn Lactobacillus, sau đó thêm nước cất đến đủ 200 mL.
Đun nóng các mẫu ở nhiệt độ để điều chỉnh pH mỗi môi trường đạt 6,0.
Ủ các mẫu ở nhiệt độ 37°C trong phòng trong 30 giờ. Trong đó: mẫu 1: rỉ đường 5%, mẫu 2: rỉ đường 10%, mẫu 3: rỉ đường 15%, mẫu 4: rỉ đường 20%, mẫu trắng: rỉ đường 5% không bổ sung vi khuẩn Lactobacillus.
Sau thời gian ủ, thể tích dung dịch các mẫu chuẩn như không đổi. Mỗi mẫu được lấy 5 mL, pha loãng đến 100 mL, sau đó tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M với chất chỉ thị phenolphtalein. Kết quả thu được như bảng sau:
a) Dựa trên kết quả thí nghiệm, giả thuyết ban đầu của nhóm học sinh là sai.
b) Phương pháp thí nghiệm này được ứng dụng để sản xuất lactic acid từ rỉ đường mà không cần sử dụng vi khuẩn Lactobacillus.
c) Quá trình lên men tạo lactic acid đạt hiệu quả tối ưu ở tỉ lệ rỉ đường 15%.
d) Trong mẫu trắng, lượng lactic acid tạo thành rất nhiều nên không xác định bằng phương pháp chuẩn độ với NaOH.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Paracetamol (còn được gọi là acetaminophen, là một loại thuốc có tác dụng hạ sốt và giảm đau. Paracetamol có thể tổng hợp trực tiếp từ 4-aminophenol và acetic anhydride theo phương trình như sau:
[Diagram showing reaction of 4-aminophenol with acetic anhydride to form Paracetamol and acetic acid.]
Để sản xuất 10000 hộp paracetamol (quy cách 10 vỉ × 10 viên mỗi hộp, mỗi viên hàm lượng 500 mg) với hiệu suất cả quá trình đạt 70% cần sử dụng tấn 4-aminophenol (độ tinh khiết 98%). Tính giá trị của m (tấn) (làm tròn đến hàng phần trăm).
Câu 2. Cho aniline tác dụng với nước bromine, sản phẩm thu được có chứa 2,4,6-tribromoaniline. Khối lượng mol ( g/mol ) của 2,4,6-tribromoaniline là bao nhiêu?
Câu 3. Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 đến 4 dưới đây:
(1) n H₂C=CH₂ → polymer (-CH₂-CH₂-)n
(2) C₆H₅-CH=CH₂ + Br₂ → C₆H₅-CHBr-CH₂Br
(3) CH₃-CH=CH-CH₂ + nBr₂ → [CH₃-(CHBr)₂-CH₂-]n
(4) n H₂N(CH₂)₅COOH → [-HN-(CH₂)₅-CO-]n + nH₂O
Gán số thứ tự phương trình hóa học của các phản ứng theo tên gọi: phản ứng cắt mạch polymer, phản ứng giữ nguyên mạch polymer, phản ứng trùng hợp, phản ứng trùng ngưng và sắp xếp theo trình tự thành dãy bốn số (ví dụ: 1234, 4321,…).
Câu 4. Trong công nghiệp, phương pháp phổ biến để sản xuất chlorine là điện phân dung dịch NaCl bão hòa (nước muối). Ngoài ra, người ta cũng sử dụng phản ứng giữa MnO₂ với HCl đặc để điều chế khí chlorine trong phòng thí nghiệm.
Cho phản ứng sau:
MnO₂(s) + 4HCl(đặc) → MnCl₂(aq) + Cl₂(g) + 2H₂O(l)
Trong phòng thí nghiệm, người ta cho 17,4 gam MnO₂ tác dụng với 150 mL dung dịch HCl đặc 12M (D = 1,06 g/mL). Giả thiết phản ứng xảy ra hoàn toàn, khí chlorine thu được được hấp thụ vào dung dịch chứa 0,5 mol NaOH. Tính khối lượng muối tạo thành trong dung dịch NaOH.
Câu 5. Tính nhiệt lượng tỏa ra khi đốt cháy 1 mol khí methane (CH₄), biết biến thiên enthalpy tạo thành chuẩn của CH₄(k), CO₂(k) và H₂O(l) lần lượt là -74,8 kJ/mol, -393,5 kJ/mol và -285,8 kJ/mol.
Câu 6. Hoà tan hoàn toàn m gam hỗn hợp gồm Na₂O và Al₂O₃ vào nước thu được 200 gam dung dịch X chỉ chứa chất tan duy nhất và khí H₂ (nếu có). Cho từ từ dung dịch HCl 0,5M vào dung dịch X đến khi thu được 11,7 gam kết tủa thì dừng lại. Thể tích dung dịch HCl đã dùng là V lít. Xác định giá trị của V.
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




