Đề thi thử Đại học 2025 môn Hóa học – THPT Chuyên ĐH Vinh là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, trong chương trình Đề thi vào Đại học.
Đề thi được biên soạn công phu, bám sát cấu trúc minh họa 2025 của Bộ GD&ĐT, với mức độ phân hóa hợp lý và nội dung phủ rộng các chuyên đề trọng tâm: este – lipit, amino axit – protein, polime, kim loại, phản ứng hóa học và các dạng bài tập vận dụng cao. Đây là tài liệu lý tưởng giúp học sinh giỏi rèn luyện kỹ năng giải đề chuyên sâu và nâng cao năng lực tư duy.
Hãy cùng Dethitracnghiem.vn thử sức với đề thi này để sẵn sàng bước vào kỳ thi quan trọng phía trước!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 THPT CHUYÊN ĐH VINH





Cho biết nguyên tử khối: H = 1, C = 12, N = 14, O = 16, Na = 23, Al = 27, P = 31, Ca = 40, Cu = 64, Zn = 65.
Hằng số Faraday, F = 96500 C.mol-1.
PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Chất nào sau đây là amine bậc hai?
A. CH3CH2N(CH3)2.
B. CH3NHCH3.
C. CH3CH2NH2.
D. CH3NH2.
Câu 2. Một trong các phương pháp bảo vệ vỏ chống ăn mòn kim loại được sử dụng rộng rãi là phương pháp điện hoá. Trong phương pháp này, người ta nối hoặc cho kim loại cần bảo vệ tiếp xúc với kim loại hoạt động hoá học mạnh hơn (kim loại hi sinh). Phát biểu nào sau đây sai?
A. Để bảo vệ vỏ tàu bằng thép, người ta gắn các lá kẽm vào phía ngoài vỏ tàu ở phần chìm trong nước biển.
B. Các electron chuyển từ kim loại hi sinh tới kim loại cần bảo vệ.
C. Sắt bị gỉ nhanh hơn khi tiếp xúc với đồng trong không khí ẩm.
D. Kim loại hi sinh luôn có thế điện cực chuẩn cao hơn kim loại cần được bảo vệ.
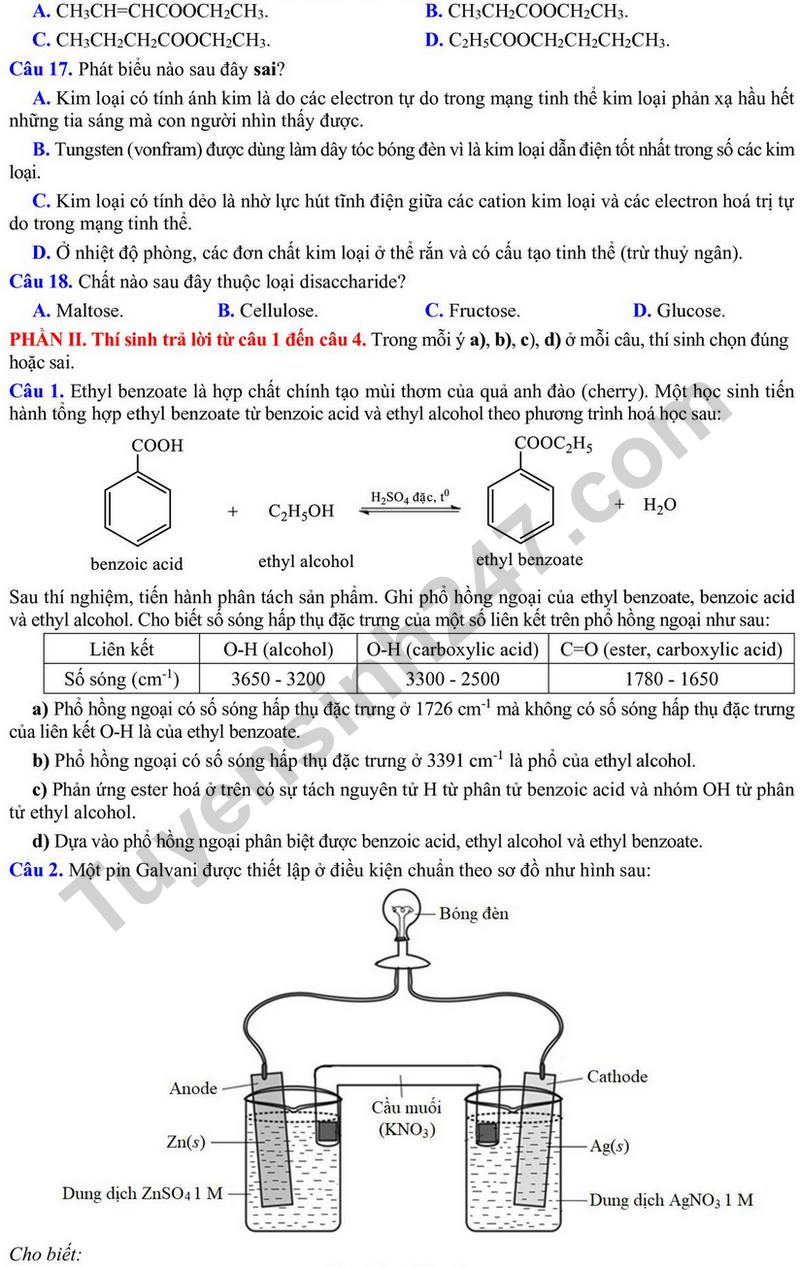
Câu 3. Cho bảng độ tan ( g/100 g nước) ở 20°C của một số muối sulfate và nitrate của kim loại nhóm IIA như sau: (hình ảnh)
Một học sinh hoà tan hoàn toàn 150 gam muối X vào 200 gam H2O ở 20°C, thu được dung dịch Y. Vậy muối X có thể là
A. Ba(NO3)2.
B. Sr(NO3)2.
C. Ca(NO3)2.
D. MgSO4.
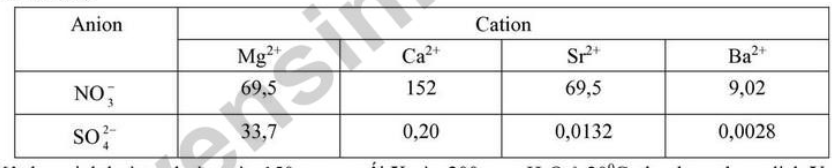
Câu 4. Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hoá – khử như sau:
Dãy gồm các ion có tính oxi hoá tăng dần từ trái sang phải ở điều kiện chuẩn là
A. Zn2+, Fe2+, Ni2+, Cu2+, Ag+.
B. Zn2+, Fe2+, Cu2+, Ag+, Ni2+.
C. Ag+, Cu2+, Ni2+, Fe2+, Zn2+.
D. Zn2+, Ni2+, Fe2+, Cu2+, Ag+.
Câu 5. Chất hữu cơ X được dùng trong sản xuất thuốc chữa bệnh, các chất phòng trừ dịch hại, chất dẫn dụ côn trùng, chất tăng tốc lưu hoá cao su và chất trức chế ăn mòn kim loại. Dung dịch X làm quỳ tím hoá xanh. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của X là 45. Chất X có thể là
A. formic acid.
B. methyl formate.
C. methylamine.
D. ethylamine.
Câu 6. Kim loại nào sau đây tan trong nước ở điều kiện thường?
A. K.
B. Cu.
C. Al.
D. Fe.
Câu 7. Tiến hành các thí nghiệm sau:
(a) Điện phân MgCl2 nóng chảy.
(b) Nhiệt phân hoàn toàn BaCO3.
(c) Cho kim loại K vào dung dịch CuSO4 dư.
(d) Dẫn khí CO dư đi qua bột Fe2O3 nung nóng.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3 dư.
Sau khi các phản ứng kết thúc, số thí nghiệm thu được kim loại là
A. 4.
B. 5.
C. 2.
D. 2.
Câu 8. Tyrosine là một trong những loại amino acid cần thiết và có thể bổ sung cho cơ thể thông qua các thực phẩm ăn uống hàng ngày. Tyrosine làm tăng mức độ chất dẫn truyền thần kinh dopamine, adrenaline và norepinephrine, giúp điều chỉnh tâm trạng, cải thiện trí nhớ, giúp tỉnh táo đầu óc và tăng khả năng tập trung. Với mỗi môi trường có giá trị pH bằng 0,10; 5,65; 9,59 và 12,90, coi tyrosine tồn tại ở dạng cho dưới đây: 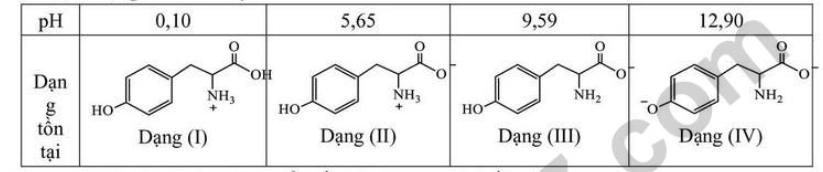
Trong quá trình điện di, ion sẽ di chuyển về phía điện cực trái dấu với ion.
Cho các nhận định sau về quá trình điện di của Tyrosine:

Các nhận định đúng là
A. (a), (c), (d).
B. (a), (b), (c).
C. (a), (c), (d).
D. (a), (b), (d).
Câu 9. Glycine là một amino acid cơ thể sử dụng để tạo ra protein và tạo ra các chất quan trọng khác gồm hormone, enzyme,… Cho m gam glycine tác dụng vừa đủ với 200 mL dung dịch NaOH 1 M, thu được dung dịch X. Phổ khối lượng của glycine như sau: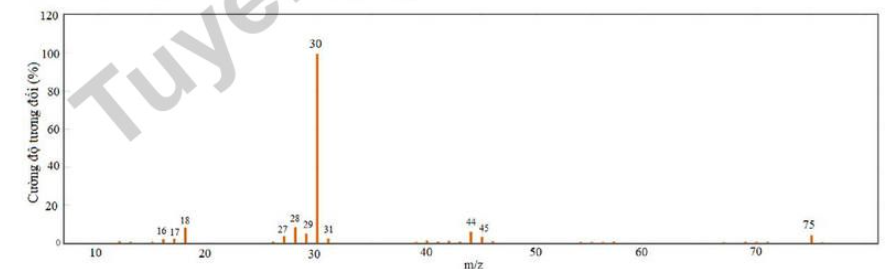
Phát biểu nào sau đây sai?
A. Glycine có tính lưỡng tính.
B. Công thức phân tử của glycine là C2H5O2N.
C. Phổ khối lượng của glycine có peak ion phân tử [Gly]+ có giá trị m/z = 75.
D. Giá trị của m là 7,5.
Câu 10. Poly(vinyl chloride) được điều chế từ phản ứng trùng hợp chất nào sau đây?
A. CH3COOCH=CH2.
B. CH2=CHCl.
C. CH2=CH2.
D. CH2=CHCH3.
Câu 11. Một nhà kho chứa các đồ vật gia dụng làm từ nhựa polypropylene (PP) như hộp bảo quản thực phẩm, chai đựng nước, bình sữa trẻ nhỏ, đồ chơi trẻ em, dụng cụ học tập (vỏ bút bi, thước kẻ, hộp đựng bút), ghế nhựa, giá nhựa, tủ, bàn học, … bị bốc cháy, tạo nên khói đám cháy có nhiệt độ rất cao và chứa các khí độc như CO, CO2,… Cho các phát biểu sau:
(a) PP là polymer mạch không nhánh, bền trong môi trường acid và môi trường base, khó phân hủy sinh học.
(b) Trong khi di chuyển ra xa đám cháy, cần cúi thấp người (nhằm tránh khỏi đám cháy), đồng thời dùng khăn ướt che mũi và miệng (để hạn chế khí độc đi vào cơ thể).
(c) Nguyên tắc chữa cháy là cách li chất cháy, cách li hoặc làm giảm ảnh hưởng của nhiệt độ, nồng độ oxygen.
(d) Để dập tắt đám cháy vật liệu trên ta có thể dùng nước và khí carbon dioxide.
Số phát biểu đúng là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 12. Phản ứng nào sau đây được gọi là phản ứng xà phòng hoá?
A. CH3COOH + NaOH → CH3COONa + H2O.
B. C17H35COOH + HCl → C17H35COOH + NaCl.
C. H2NCH2COOH + NaOH → H2NCH2COONa + H2O.
D. CH3COOC2H5 + NaOH → CH3COONa + C2H5OH.
Câu 13. Cho phản ứng: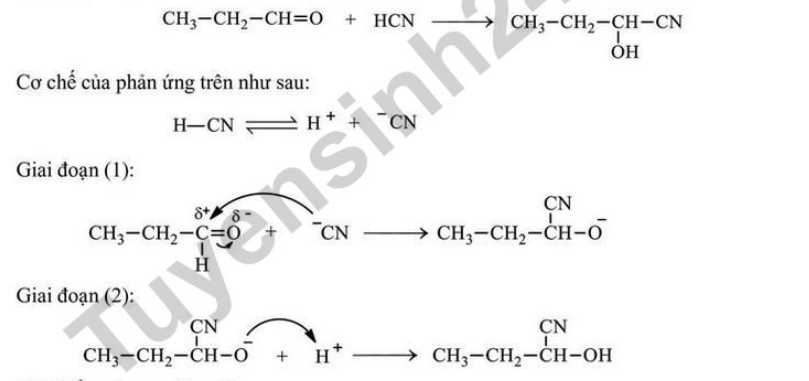 Phát biểu nào sau đây sai?
Phát biểu nào sau đây sai?
A. Trong giai đoạn (1), có sự phân cắt liên kết π và hình thành liên kết σ.
B. Thay CH3CH2CHO bằng CH3COCH3 thì phản ứng trên không xảy ra.
C. Phản ứng trên là phản ứng cộng nucleophile vào hợp chất carbonyl.
D. Trong giai đoạn (2), có sự tạo thành liên kết O–H.
Câu 14. Trên bao bì một loại phân bón NPK của công ty phân bón Việt Nhật có ghi độ dinh dưỡng là 16 – 16 – 8. Khối lượng phosphorus có trong 355 kg phân bón NPK này là
A. 12,4 kg.
B. 56,8 kg.
C. 28,4 kg.
D. 24,8 kg.
Câu 15. Chất nào sau đây là muối axit?
A. NaNO3.
B. NaOH.
C. Na2CO3.
D. NaHCO3.
Câu 16. Ethyl butyrate là ester có mùi thơm của dứa. Công thức của ethyl butyrate là
A. CH3CH2CH2COOCH3.
B. CH3CH2COOCH2CH3.
C. CH3CH2CH2COOCH2CH3.
D. C2H5COOCH2CH2CH3.
Câu 17. Phát biểu nào sau đây sai?
A. Kim loại có tính ánh kim là do các electron tự do trong mạng tinh thể kim loại phản xạ hầu hết những tia sáng mà con người nhìn thấy được.
B. Tungsten (vonfram) được dùng làm dây tóc bóng đèn vì là kim loại dẫn điện tốt nhất trong số các kim loại.
C. Kim loại có tính dẻo nhờ lực hút tĩnh điện giữa các cation kim loại và các electron hoá trị tự do trong mạng tinh thể.
D. Ở nhiệt độ phòng, các đơn chất kim loại ở thể rắn và có cấu tạo tinh thể (trừ thủy ngân).
Câu 18. Chất nào sau đây thuộc loại disaccharide?
A. Maltose.
B. Cellulose.
C. Fructose.
D. Glucose.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 6. Trong mỗi câu hỏi ở phần này, thí sinh cần trình bày cách giải.
Câu 1. Phenol (C6H5OH) là chất rắn kết tinh không màu, nóng chảy ở 43°C, dễ bị oxi hoá trong không khí tạo sản phẩm có màu hồng, ít tan trong nước lạnh nhưng tan nhiều trong nước nóng. Phenol được dùng làm nguyên liệu sản xuất nhựa phenolformaldehyde, chất diệt nấm mốc, thuốc sát trùng,…
a) Phenol có tính acid mạnh hơn carbonic acid do gốc phenyl hút electron làm mật độ electron ở nguyên tử oxygen tăng lên.
b) Phenol tham gia phản ứng thế bromine vào vòng benzene dễ hơn benzene do ảnh hưởng của nhóm –OH.
c) Phenol có thể phản ứng với dung dịch NaOH.
d) Để chứng minh trong phân tử phenol có nhóm –OH và vòng benzene, ta dùng dung dịch brom và dung dịch NaOH.
Số phát biểu đúng là…
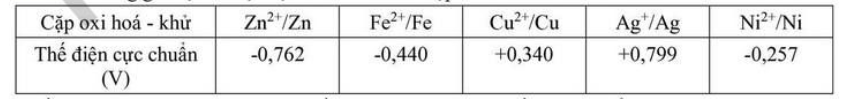
Câu 2. Cho các thông tin sau: (hình ảnh)
Bảng: Cặp oxi hóa – khử | Thế điện cực chuẩn (V)
| Zn2+/Zn | -0,762 | E°Fe2+/Fe | -0,440 | E°Ag+/Ag | +0,799 |
Trong đó: Amax là điện năng cực đại (J hay Ws), q là điện lượng (C hay As), ne là số mol electron đi qua dây dẫn, E0pin là sức điện động chuẩn của pin (V), P là công suất của bóng đèn (W), t là thời gian bóng đèn được thắp sáng liên tục (s).
A. Sức điện động chuẩn của pin là 0,037 V.
B. Khối lượng Zn cần sử dụng trong pin để cung cấp một điện lượng bằng 17370 mAh là 21,06 gam (giả thiết hiệu suất các quá trình đều bằng 100%).
C. Với pin đã cho ở trên, nếu nối với bóng đèn có công suất 20 W thì thời gian bóng đèn được thắp sáng liên tục là 75531 giây.
D. Ở cathode xảy ra quá trình oxi hoá ion Ag+.
Các phát biểu trên đúng hay sai?
Câu 3. Để mạ đồng cho một tấm kim loại hình chữ nhật bằng sắt với độ dày và diện tích lớp mạ lần lượt là 0,1 mm và 88,5 cm2, người ta tiến hành điện phân dung dịch CuSO4 (điện cực là tấm kim loại cần mạ và điện cực dương là đồng (copper) thô), hiệu suất điện phân 100%) với cường độ dòng điện không đổi 2 A. Khi kết thúc điện phân (quá trình mạ hoàn thành) thì hết t giây. Cho biết:
Khối lượng riêng của kim loại Cu là 8,96 g/cm3 và giả thiết toàn bộ lượng kim loại Cu sinh ra đều bám hết vào tấm kim loại cần mạ, nước không bị điện phân ở cả hai điện cực.
Điện lượng: q = It = ne.F, trong đó: q là điện lượng (C), ne là số mol electron đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian điện phân (giây).
A. Tấm kim loại hình chữ nhật đóng vai trò là anode và tại điện cực này xảy ra quá trình khử ion Cu2+.
B. Giá trị của t là 23912.
C. Lượng CuSO4 trong dung dịch không đổi trong quá trình điện phân.
D. Lớp đồng thô đóng vai trò là cathode và tại điện cực này xảy ra quá trình oxi hoá kim loại Cu.
Các phát biểu trên đúng hay sai?
Câu 4. Tiến hành thí nghiệm phản ứng màu biuret theo các bước sau:
Bước 1: Cho vào ống nghiệm khoảng 1 mL dung dịch NaOH 30%, thêm vài giọt dung dịch CuSO4 2%, lắc đều.
Bước 2: Thêm tiếp vào ống nghiệm khoảng 3 mL dung dịch protein (lòng trắng trứng), lắc đều hỗn hợp, rồi đặt lên giá ống nghiệm khoảng 2 – 3 phút.
a) Sau bước 1, trong ống nghiệm xuất hiện kết tủa màu xanh.
b) Kết quả thí nghiệm chứng tỏ phân tử protein có nhiều liên kết peptide.
c) Sau bước 2, kết tủa trong ống nghiệm bị hoà tan và tạo thành dung dịch có màu vàng.
d) Thí nghiệm này còn được dùng để nhận biết dung dịch protein.
Các phát biểu trên đúng hay sai?
Câu 5. Dung dịch X chứa các ion Na+, Ca2+, Mg2+, Ba2+, H+, Cl–, SO42-, NO3–. Chia dung dịch X thành hai phần bằng nhau.
Phần 1: Cho tác dụng với dung dịch NaOH dư, đun nóng, thu được 0,17 gam kết tủa Y và 0,01 mol khí Z.
Phần 2: Cho tác dụng với dung dịch Na2CO3 dư, thu được 1,34 gam kết tủa T.
Mặt khác, lấy 50 mL dung dịch X tác dụng với một lượng dư dung dịch BaCl2, thu được 0,466 gam kết tủa.
Trong 200 mL dung dịch X có bao nhiêu gam muối tan?
Câu 6. Cho 500 mL dung dịch hỗn hợp chứa NaOH 0,1M và Ba(OH)2 0,05M tác dụng với V mL dung dịch chứa Al2(SO4)3 x M.
a) Khi V = 100 mL, thu được 1,602 gam kết tủa. Tính x.
b) Khi V = 200 mL, thu được 3,75 gam kết tủa. Tính x.
c) Khi V = 300 mL, thu được 3,75 gam kết tủa. Tính x.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Calcium oxide (CaO) còn được gọi là vôi sống, phần lớn được dùng làm vật liệu xây dựng. Ngoài ra, nó còn được dùng để làm chất hút ẩm trong công nghiệp, khử chua đất, tẩy uế,… Có thể sản xuất vôi sống bằng cách nung đá vôi (CaCO3) trong lò nung theo phương trình hoá học (1) như sau:
CaCO3(s) → CaO(s) + CO2(g) (1)
Phản ứng (1) là phản ứng thu nhiệt. Lượng nhiệt này được cung cấp từ quá trình đốt cháy hoàn toàn carbon trong lò nung theo phương trình hoá học (2):
C(graphite) + O2(g) → CO2(g) (2)
Xét các phản ứng ở điều kiện chuẩn, hiệu suất chuyển hoá calcium carbonate thành calcium oxide là 100%. Tính khối lượng calcium oxide sản xuất được (theo tấn, làm tròn đến hàng đơn vị) trong các quá trình trên khi đốt cháy hoàn toàn 14,4 tấn carbon (graphite). Biết có 85% nhiệt lượng toả ra từ phản ứng (2) được cung cấp cho phản ứng (1) và các giá trị nhiệt tạo thành (ΔfH0298) của các chất ở điều kiện chuẩn được cho trong bảng sau: (hình ảnh)
Chất | CaCO3(s) | CO2(g) | CaO(s) | C(graphite) ----------|----------|---------|--------|------------ ΔfH0298 (kJ.mol-1) | -1206,9 | -393,5 | -635,1 | 0,0
Câu 2. Trong công nghiệp, aluminium được sản xuất bằng phương pháp điện phân aluminium oxide nóng chảy với hai điện cực bằng than chì, hiệu suất điện phân 100%. Quá trình điện phân được tiến hành với dòng điện có hiệu điện thế 5 V không đổi. (hình ảnh)
Cho biết: 1 kWh = 3,6.106 J.
Điện lượng: q = ne.F.
Điện năng tiêu thụ: Atiêu thụ = q.U, trong đó: q là điện lượng (C), Atiêu thụ là điện năng tiêu thụ (J), U là hiệu điện thế (V), ne là số mol electron đi qua dây dẫn.
Tính điện năng tiêu thụ để sản xuất được 27 kg aluminium (theo kWh, làm tròn đến hàng đơn vị).
Câu 3. Cho sơ đồ điều chế ethanol bằng phương pháp lên men tinh bột như sau:
Tinh bột → Glucose → Ethanol
(+H2O, enzyme) (enzyme)
(1) (2)
Lên men 121,5 kg sắn khô (chứa 36% khối lượng là tinh bột, còn lại là các chất không có khả năng lên men thành ethanol) với hiệu suất mỗi quá trình (1) và (2) lần lượt là 90% và 80%. Toàn bộ lượng ethanol sinh ra để pha chế xăng E5 (có chứa 5% thể tích ethanol). Biết khối lượng riêng của ethanol nguyên chất là 0,8 g/mL. Tính thể tích xăng E5 thu được sau pha trộn (theo lít, làm tròn đến hàng đơn vị).
Câu 4. Xà phòng hóa hỗn hợp muối sodium hoặc potassium của các acid béo và các chất phụ gia. Hỗn hợp X gồm tristearin, tripalmitin, stearic acid và palmitic acid (tỉ lệ mol ntristearin : ntripalmitin = 1 : 1 và nstearic acid : npalmitic acid = 2 : 1). Để sản xuất b bánh xà phòng (mỗi bánh đều nặng 75 gam và chứa 75% muối của các acid béo theo khối lượng), người ta cho 863,92 gam hỗn hợp X tác dụng vừa đủ với 306 gam dung dịch NaOH 40%, đun nóng. Biết hiệu suất toàn bộ quá trình sản xuất xà phòng là 100%. Tính giá trị của b (làm tròn đến hàng đơn vị).
Câu 5. Sodium carbonate (Na2CO3) là chất thường dùng để làm mềm nước cứng theo phương pháp kết tủa. Độ cứng của nước có thể được tính theo số mg CaCO3 trong 1 lít nước, trong đó độ cứng không vượt quá 60 mg.L-1 là nước mềm. Để xử lí một mẫu nước cứng vĩnh cửu có độ cứng a (mg CaCO3/L) người ta cho 1 lít dung dịch Na2CO3 0,020 M vào 19 lít mẫu nước cứng, lắc đều, thu được kết tủa CaCO3 và nước mềm Y. Nồng độ Ca2+ và CO32- có trong nước mềm Y lần lượt là 5,00.10-4 M và 8,93.10-6 M. Giả thiết rằng, mẫu nước cứng chỉ chứa Ca2+ và các ion khác, các ion khác này không tham gia phản ứng, ion CO32- và ion Ca2+ không bị thủy phân trong nước. Tính giá trị của a (làm tròn đến hàng đơn vị).
Câu 6. Có tổng số bao nhiêu đồng phân amine ứng với công thức phân tử C3H9N?
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




