Đề thi thử Đại học 2025 môn Hóa học – Đề 12 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề số 12 được xây dựng dựa trên định hướng ra đề mới nhất của Bộ GD&ĐT năm 2025, giúp học sinh lớp 12 rèn luyện toàn diện cả kiến thức lý thuyết và kỹ năng làm bài trắc nghiệm. Các câu hỏi trong đề bám sát cấu trúc chuẩn, phân bố từ mức độ nhận biết – thông hiểu đến vận dụng – vận dụng cao, bao trùm các chuyên đề quan trọng như: Cấu tạo nguyên tử – bảng tuần hoàn, phản ứng oxi hóa – khử, axit – bazơ – muối, kim loại và hợp chất, hữu cơ cơ bản, este – lipit, amin – amino axit – protein, và bài toán đồ thị – thực nghiệm hóa học.
Những điểm học sinh cần chú trọng để chinh phục đề số 12:
- Thành thạo các dạng bài tập đếm chất, nhận biết, và chuỗi phản ứng hóa học.
- Áp dụng tốt phương pháp bảo toàn (nguyên tố, khối lượng, electron) trong bài tập tổng hợp.
- Luyện tập phân tích dữ liệu từ đồ thị và bảng số liệu hóa học.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 – ĐỀ 12






PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
Câu 1. Trong y học, chất X được sử dụng để điều trị chứng dư acid ở dạ dày. Trong đời sống và sản xuất X có ứng dụng làm tăng độ xốp cho bánh, làm mềm thực phẩm. Chất X là
A. NaHCO₃.
B. Na₂SO₄.
C. Na₂CO₃.
D. NaHSO₄.
Câu 2. Phát biểu nào dưới đây không đúng
A. Khi thay thế một hay nhiều nguyên tử hydrogen trong phân tử ammonia bằng một hay nhiều gốc hydrocarbon,thu được amin.
B. Methylamine là chất lỏng ở điều kiện thường có mùi khó chịu.
C. Ethylamine là amin bậc 1.
D. Dung dịch aniline trong nước không đổi màu quỳ tím.
Câu 3. Tiến hành thí nghiệm sau:
Cho vào ống nghiệm vài giọt dung dịch CuSO₄ 2% và 1 ml dung dịch NaOH 30%. Lắc nhẹ, gạn lớp dung dịch để giữ kết tủa. Thêm khoảng 3 ml lòng trắng trứng vào ống nghiệm, dùng đũa thủy tinh khuấy đều.
Phát biểu nào sau đây đúng?
A. Phản ứng xảy ra trong thí nghiệm trên gọi là phản ứng màu biure.
B. Dung dịch thu được sau phản ứng có màu xanh lam.
C. Nếu thay lòng trắng trứng bằng Gly-Ala thì hiện tượng xảy ra tương tự
D. Trong thí nghiệm trên có phản ứng đông tụ protein.
Câu 4. Để phân tích thổ nhưỡng hoặc phân tích dư lượng thuốc bảo vệ thực vật trong nông sản người ta dùng phương pháp nào sau đây?
A. Chiết lỏng – lỏng.
B. Chiết lỏng – rắn.
C. Phương pháp kết tinh.
D. Sắc kí cột.
Câu 5. Tích số ion của nước ở 25°C là
A. Kw = [H⁺][OH⁻]=10⁻⁷ M.
B. Kw = [H⁺][OH⁻]= 10⁻¹⁴ M.
C. \( K_w = \dfrac{[\text{H}^+]}{[\text{OH}^-]} = 10^{-4} \, \text{M} \)
D. \( K_w = \dfrac{[\text{OH}^-]}{[\text{H}^+]} = 10^{-14} \, \text{M} \)
Câu 6. Phân tử saccharose được tạo thành bởi
A. một đơn vị α-glucose và một đơn vị β-fructose, liên kết với nhau qua nguyên tử oxygen.
B. một đơn vị β-glucose và một đơn vị α-fructose, liên kết với nhau qua nguyên tử oxygen.
C. một đơn vị α-glucose và một đơn vị β-fructose, liên kết với nhau qua nguyên tử carbon.
D. một đơn vị β-glucose và một đơn vị α-fructose, liên kết với nhau qua nguyên tử carbon.
Câu 7. Lắp pin Galvani Zn-Cu gồm điện cực kẽm và điện cực đồng được nối với nhau bởi cầu muối (chứa dung dịch KCl bão hòa) như hình vẽ. Quá trình xảy ra ở điện cực âm, anode là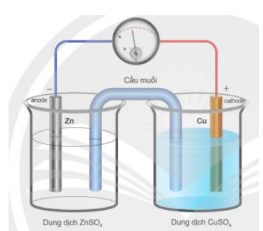
A. quá trình khử Zn²⁺.
B. quá trình khử Cu²⁺.
C. quá trình oxi hóa Zn.
D. quá trình oxi hóa Cu.
Câu 8. Để xác định thế điện cực chuẩn của một kim loại, người ta thiết lập một pin điện hóa gồm điện cực chuẩn của kim loại cần xác định với điện cực
A. oxygen chuẩn.
B. nitrogen chuẩn.
C. hydrogen chuẩn.
D. helium chuẩn.
Câu 9. Thực hiện thí nghiệm gồm các bước: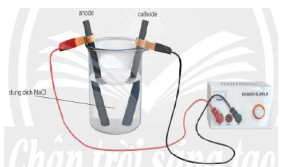
Bước 1: Lấy 500 mL nước cất vào cốc thủy tinh. Sau đó cho khoảng 150 g muối ăn và khuấy đều đến khi tan hết.
Bước 2: Cắm hai điện cực than chì vào cốc thủy tinh (như hình vẽ). Nối dây dẫn nguồn điện một chiều (3 V – 6 V) và duy trì quá trình điện phân trong khoảng 5 phút. Đây là quá trình điều chế hóa chất nào?
A. Sodium.
B. Khí chlorine.
C. Dung dịch sodium hydroxide.
D. Nước Javel.
Câu 10. Nước ta có nguồn tài nguyên khoáng sản đa dạng và phong phú như quặng bauxite (Tây Nguyên, Lạng Sơn, Cao Bằng,…), quặng hematite (Thái Nguyên, Yên Bái, Hà Tĩnh,…). Thành phần chính của quặng bauxite và quặng hematite lần lượt là
A. FeS₂ và Na₃AlF₆.
B. Fe₃O₄ và Al₂O₃.
C. Al₂O₃ và Fe₂O₃.
D. Al₂O₃ và Fe₃O₄.
Câu 11. Những tính chất vật lí của kim loại chủ yếu do các electron tự do trong kim loại gây ra là
A. tính ánh kim, tính dẫn điện, tính dẫn nhiệt, tính dẻo.
B. tính ánh kim, tính dẫn điện, tính dẫn nhiệt, độ cứng.
C. tính ánh kim, nhiệt độ nóng chảy, tính dẫn nhiệt, tính dẻo.
D. khối lượng riêng, tính dẫn điện, tính dẫn nhiệt, tính dẻo.
Câu 12. Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron lớn nhất.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 13. Tơ là những vật liệu
A. hình sợi dài và mảnh với độ bền nhất định.
B. có tính dẻo.
C. có tính đàn hồi.
D. có khả năng kết dính bề mặt của hai vật liệu sẵn với nhau.
Câu 14. Khi tàu thuyền neo đậu, mỏ neo của chúng sẽ được thả xuống đáy sông. Hợp kim của kim loại nào sau đây có thể dùng làm mỏ neo?
A. Iron.
B. Aluminium.
C. Sodium.
D. Magnesium.
Câu 15. Đốt cháy đoạn dây magnesium trong lọ đựng khí oxygen dư. Trong phản ứng này, magnesium đã
A. bị khử.
B. bị oxi hoá.
C. nhận electron.
D. nhận proton.
Câu 16. Phát biểu nào sau đây đúng?
A. Các kim loại chuyển tiếp dãy thứ nhất đều có nhiệt độ nóng chảy cao hơn các kim loại nhóm IA và nhóm IIA.
B. Các kim loại chuyển tiếp dãy thứ nhất có xu hướng thể hiện nhiều trạng thái oxi hoá.
C. Tất cả hợp chất của kim loại chuyển tiếp dãy thứ nhất đều có màu.
D. Cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất đều có phân lớp 4s đã bão hoà.
Câu 17. Cho biết giá trị thế điện cực chuẩn của các cặp oxi hoá – khử sau:
Cho các phản ứng hoá học sau:
(1) Zn(s) + 2Fe³⁺(aq) → Zn²⁺(aq) + 2Fe²⁺(aq)
(2) Ni(s) + 2Fe³⁺(aq) → Ni²⁺(aq) + 2Fe²⁺(aq)
(3) Cu(s) + 2Fe³⁺(aq) → Cu²⁺(aq) + 2Fe²⁺(aq)
(4) Fe²⁺(aq) + Ag⁺(aq) → Fe³⁺(aq) + Ag(s)
Ở điều kiện chuẩn, số phản ứng hoá học xảy ra theo chiều thuận là
A. 3.
B. 4.
C. 1.
D. 2.
Câu 18. Ba chất hữu cơ X, Y và Z có cùng công thức phân tử C₄H₈O₂, có đặc điểm sau:
+ X có mạch carbon phân nhánh, tác dụng được với Na và NaOH.
+ Y được điều chế trực tiếp từ carboxylic acid và alcohol có cùng số nguyên tử carbon.
+ Z tác dụng được với NaOH và có tham gia phản ứng tráng bạc.
Các chất X, Y, Z có công thức cấu tạo lần lượt là
A. CH₃CH₂CH₂COOH, CH₃COOCH₂CH₃, HCOOCH₂CH₂CH₃.
B. CH₃CH(CH₃)COOH, CH₃CH₂COOCH₃, HCOOCH₂CH₂CH₃.
C. CH₃CH(CH₃)COOH, CH₃COOCH₂CH₃, HCOOCH₂CH₂CH₃.
D. CH₃CH₂CH₂COOH, CH₃COOCH₂CH₃, CH₃COOCH₂CH₃.
PHẦN II. Câu hỏi trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 3. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
Câu 1: Xà phòng, chất giặt rửa được dùng để loại bỏ các vết bẩn bám trên quần áo, bề mặt các vật dụng. Cho công thức của muối sau: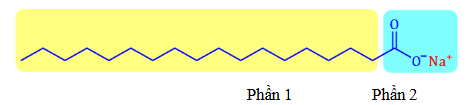
Hãy cho biết những phát biểu sau là đúng hay sai?
a. Muối trên có trong thành phần chính của xà phòng và có tên là sodium palmitate.
b. Có thể điều chế muối trên từ phản ứng giữa (C₁₇H₃₅COO)₃C₃H₅ với dung dịch NaOH vừa đủ.
c. Phần 1 là phần phân cực (đuôi dài kị nước) và phần 2 là phần không phân cực (đầu ưa nước).
d. Trong quá điều sản xuất xà phòng, có thể thêm vào muối trên một số chất phụ gia như chất độn, chất tạo màu, chất tạo hương, chất dưỡng da, chất diệt khuẩn,…
Câu 2. Xét tính chất hóa học của saccharose.
a. Saccharose có khả năng hòa tan Cu(OH)₂ trong môi trường kiềm ở điều kiện thường tạo dung dịch xanh lam.
b. Saccharose bị thủy phân trong môi trường acid, base hoặc xúc tác enzyme.
c. Thủy phân hoàn toàn saccharose trong môi trường acid thu được glucose và fructose.
d. Saccharose có khả năng phản ứng với thuốc thử Tollens.
Câu 3: Peptide được phân loại theo số lượng đơn vị α-amino acid trong phân tử. Với số lượng các α-amino acid khác nhau cũng gây ra một số phản ứng khác nhau của peptide.
a. Phân tử tripeptide Gly-Ala-Val có 6 nguyên tử oxi.
b. (Ala- Gly và Gly-Ala là 2 tên gọi của cùng một phân tử dipeptide.
c. Trong phân tử pentapeptide Gly-Ala-Val-Glu-Lys, amino acid đầu N là Lys.
d. Trùng ngưng các amino acid thu được polyamide.
Câu 4: Hãy cho biết nhận định nào đúng/sai ?
a. Kim loại sodium (Na) được điều chế bằng cách điện phân nóng chảy NaCl.
b. Khi mạ đồng lên một chiếc thìa bằng sắt thì phải dùng dung dịch muối Cu²⁺.
c. Phương pháp điện phân có thể dùng để làm sạch, tinh chế các kim loại.
d Để hạ nhiệt độ nóng chảy của quá trình điện phân Al₂O₃ phải dùng quặng bauxite. Sai, dùng cryolite.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Cho các điều kiện sau: (1) môi trường acid; (2) môi trường base; (3) đun nóng và (4) sự có mặt của ion kim loại nặng. Có bao nhiêu điều kiện gây ra sự đông tụ của protein?
Câu 2. Hydrogen hóa hoàn toàn 1 mol triglyceride X cần 5 mol H₂ (Ni, t°) thu được chất hữu cơ Y. Thủy phân hoàn toàn Y bằng dung dịch NaOH, đun nóng thu được glycerol và sodium stearate. Phân tử khối của X là bao nhiêu?.
Câu 3. Tiến hành các thí nghiệm điện phân với điện cực trơ sau:
(a) Điện phân dung dịch sodium chloride nóng chảy.
(b) Điện phân aluminium oxide nóng chảy.
(c) Điện phân dung dịch sodium chloride với màng ngăn xốp.
(d) Điện phân dung dịch copper(II) sulfate.
(e) Điện phân dung dịch nikel sulfate.
Có bao nhiêu quá trình điện phân tạo được kim loại?
Câu 4. Hòa tan hoàn toàn 320 gam quặng hematite (chứa 25% tạp chất) trong dung dịch HNO₃ 42% vừa đủ thu được dung dịch X. Làm lạnh dung dịch X xuống 5°C, thấy có 691,51 gam tinh thể tách ra. Tính khối lượng mol của tinh thể tách ra (Biết rằng độ tan của dung dịch X ở 5°C là 53,14).
Câu 5. Điện phân nóng chảy hỗn hợp gồm Al₂O₃ (10%) và cryolite (90%) với anode là than cốc và cathode là than chì. Sau thời gian điện phân thu được 2,16 tấn Al tại cathode và hỗn hợp khí tại anode gồm CO₂ (80% theo thể tích) và CO (20% theo thể tích). Giả thiết không có thêm sản phẩm nào được sinh ra trong quá trình điện phân. Tính khối lượng carbon (theo tấn) đã bị oxi hoá tại anode
Câu 6. Theo luật tiêu chuẩn và Quy chuẩn kỹ thuật, tấm gương soi X có kích thước 2,4m*2m cần tráng một lớp bạc có chiều dày cần thiết được qui ra tổng lượng bạc trên một đơn vị mét vuông kính là 0,7g/m². Nếu sử dụng 342,25 gam saccharose (có lẫn 20% tạp chất) để thủy phân rồi thực hiện phản ứng tráng gương thì lượng bạc thu được sẽ tráng được bao nhiêu tấm gương X như trên nếu hiệu suất của toàn bộ quá trình đạt 50%?
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ vào các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục tiêu chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Dùng kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các trường đại học, cao đẳng trong công tác tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục ở từng địa phương và trên toàn quốc, từ đó phục vụ việc điều chỉnh nội dung, phương pháp giảng dạy trong các cơ sở giáo dục.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 phải tham gia ba bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh chọn một trong hai bài thi tổ hợp sau:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí, Giáo dục công dân (áp dụng với học sinh học chương trình GDPT).
Trong bài thi tổ hợp KHTN, môn Hóa học là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi Hóa học, trừ khi lựa chọn bài thi KHTN để xét tốt nghiệp hoặc xét tuyển đại học, cao đẳng vào các ngành yêu cầu môn này.
Vì vậy, Đề thi thử tốt nghiệp THPT 2025 môn Hóa học – Đề 12 là tài liệu tham khảo hữu ích cho các thí sinh lựa chọn tổ hợp KHTN. Đề thi giúp học sinh luyện tập kiến thức, kiểm tra năng lực hiện tại, và nâng cao kỹ năng làm bài để chuẩn bị tốt nhất cho kỳ thi chính thức sắp tới.




