Đề thi thử Đại học 2025 môn Hóa học – Đề 13 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề số 13 được xây dựng công phu, có cấu trúc bám sát theo đề minh họa 2025 của Bộ GD&ĐT, nhằm giúp học sinh lớp 12 luyện tập kỹ năng giải đề chuẩn bị cho kỳ thi tốt nghiệp THPT quốc gia. Đề thi bao gồm đầy đủ các phần kiến thức quan trọng từ chương trình Hóa học 10 đến Hóa học 12, đặc biệt nhấn mạnh vào các chủ đề như: Este – Lipit, Amin – Amino axit – Protein, Đại cương kim loại – dãy điện hóa, Cân bằng hóa học – tốc độ phản ứng – điện phân, bài toán xác định công thức cấu tạo và các câu hỏi đồ thị tích hợp.
Những kỹ năng và kiến thức học sinh cần nắm để xử lý hiệu quả đề số 13:
- Hiểu rõ bản chất các phản ứng hữu cơ – vô cơ và chuỗi chuyển hóa chất.
- Kỹ năng làm bài nhanh với các dạng bài toán bảo toàn, hỗn hợp nhiều chất.
- Phân tích và xử lý dữ kiện phức tạp trong các câu hỏi vận dụng cao và câu có dữ liệu thực nghiệm.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 – ĐỀ 13






PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Tên gọi của ester CH₃COOCH₃ là
A. ethyl acetate.
B. methyl propionate.
C. methyl acetate.
D. ethyl formate.
Câu 2. Phản ứng thủy phân ester trong môi trường kiềm còn được gọi là phản ứng
A. ester hóa.
B. xà phòng hóa.
C. trung hòa.
D. trùng ngưng.
Câu 3. Glucose thể hiện đầy đủ tính chất hóa học của
A. alcohol đa chức và aldehyde đơn chức.
B. alcohol đa chức và aldehyde đa chức.
C. alcohol đơn chức và aldehyde đa chức.
D. alcohol đơn chức và aldehyde đa chức.
Câu 4. Số đồng phân cấu tạo của amine bậc một có cùng công thức phân tử C₄H₁₁N là
A. 4.
B. 5.
C. 2.
D. 3.
Câu 5. “Amino acid là hợp chất hữu cơ tạp chức, trong phân tử chứa đồng thời nhóm chức .. (1) … và nhóm chức … (2) …”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A. carboxyl (-COOH) , amino (-NH₂).
B. carboxyl (-COOH), hydroxyl (-OH).
C. hydroxyl (-OH), amino (-NH₂).
D. carbonyl (-CO), carboxyl (-COOH).
Câu 6. Polymer dùng để chế tạo thuỷ tinh hữu cơ được điều chế bằng phản ứng trùng hợp
A. CH₂=C(CH₃)COOCH₃.
B. CH₂=CHCOOCH₃.
C. C₂H₅CH=CH₂.
D. CH₃COOCH=CH₂.
Câu 7. Phương trình hoá học của phản ứng hydrate hóa ethylene để điều chế ethanol là:
CH₂ = CH₂ + H₂O -(H₂SO₄, t⁰)→ CH₃CH₂OH
Giai đoạn (1) trong cơ chế của phản ứng trên xảy ra như sau: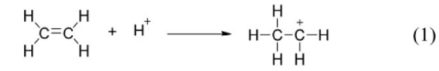 Nhận định nào sau đây không đúng?
Nhận định nào sau đây không đúng?
A. Phản ứng hydrate hóa ethylene là phản ứng cộng.
B. Trong giai đoạn (1) có sự phân cắt liên kết π.
C. Trong giai đoạn (1) có sự hình thành liên kết σ.
D. Trong phân tử ethylene có 5 liên kết σ.
Câu 8. Kí hiệu cặp oxi hoá – khử tương ứng với quá trình khử:
Fe(OH)₃ + 1e ⇌ Fe(OH)₂ + OH⁻ là
A. Fe³⁺/Fe²⁺.
B. Fe²⁺/Fe.
C. Fe³⁺/Fe.
D. Fe(OH)₃/Fe(OH)₂.
Câu 9. Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa – khử như sau:
Trong số các ion kim loại gồm Fe²⁺, Cu²⁺ và Zn²⁺, ở điều kiện chuẩn ion nào có tính oxi hóa yếu hơn Ag⁺, nhưng mạnh hơn Pt³⁺ ?
A. Fe²⁺, Cu²⁺, Zn²⁺.
B. Fe²⁺, Cu²⁺.
C. Zn²⁺.
D. Cu²⁺.
Câu 10. “Ăn mòn hóa học là quá trình …(1)…, trong đó các electron của …(2)… chuyển trực tiếp đến các chất trong môi trường”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A. oxi hóa – khử, kim loại.
B. khử, kim loại.
C. oxi hoá, ion kim loại.
D. oxi hóa – khử, ion kim loại.
Câu 11. Ở trạng thái cơ bản, cấu hình electron của nguyên tử Mg (Z = 12) là
A. 1s²2s²2p⁶3s¹.
B. 1s²2s²2p⁶3s².
C. 1s²2s²2p⁶3s².
D. 1s²2s²2p⁶3s².
Câu 12. Kim loại có những tính chất vật lí chung nào sau đây?
A. Tính dẻo, tính dẫn điện, nhiệt độ nóng chảy cao.
B. Tính dẫn điện, tính dẫn nhiệt, có khối lượng riêng lớn và có ánh kim.
C. Tính dẻo, tính dẫn điện, tính dẫn nhiệt và ánh kim.
D. Tính dẻo, có ánh kim, rất cứng.
Câu 13. Liên kết kim loại là liên kết được hình thành giữa
A. các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại.
B. các cation và các anion trong tinh thể kim loại.
C. các electron hoá trị trong tinh thể kim loại.
D. các nguyên tử trong tinh thể kim loại.
Câu 14. Thành phần chính của baking soda là NaHCO₃. Tên của hợp chất này là
A. sodium hydrogencarbonate.
B. sodium carbonate.
C. sodium hydrogensulfide.
D. potassium hydrogencarbonate.
Câu 15. Hóa chất nào sau đây không sử dụng để làm mềm nước cứng tạm thời?
A. Na₂CO₃.
B. Na₃PO₄.
C. Ca(OH)₂.
D. HCl.
Câu 16. Thuỷ ngân (Hg) là chất lỏng ở điều kiện thường, dễ bay hơi và hơi thuỷ ngân rất độc. Khi nhiệt kế thuỷ ngân bị vỡ, để tránh thuỷ ngân phân tán ra môi trường xung quanh, người ta gom thuỷ ngân lại rồi trộn với chất nào sau đây (ở dạng bột)?
A. Carbon (C).
B. Magnesium (Mg).
C. Iron (Fe).
D. Sulfur (S).
Câu 17. Trong quá trình trồng trọt, người nông dân được khuyến cáo không bón vôi sống (thành phần chính là CaO ) cùng với phân đạm ammonium. Nguyên nhân của khuyến cáo này là
A. thất thoát đạm vì giải phóng ammonia.
B. tạo thành hỗn hợp gây cháy nổ.
C. tạo acid làm ảnh hưởng tới cây trồng.
D. làm tăng độ chua của đất.
Câu 18. Phổ khối lượng (MS) là phương pháp hiện đại để xác định phân tử khối của các hợp chất hữu cơ. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của hợp chất hữu cơ X là 74 . Chất X có thể là
A. acetic acid.
B. methyl acetate.
C. acetone.
D. trimethylamine.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Acid alpha-linolenic (ALA) là một acid béo thiết yếu, cơ thể chúng ta không thể tự tổng hợp được chất này và cần phải nạp vào thông qua chế độ ăn uống. ALA đóng vai trò quan trọng trong việc duy trì sức khỏe tổng thể và có thể mang lại nhiều lợi ích. Công thức khung của ALA có dạng như sau: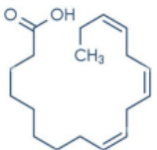 a. ALA là chất béo thuộc loại omega-3.
a. ALA là chất béo thuộc loại omega-3.
b. Trong cấu tạo của ALA có 2 liên kết đôi C=C ở dạng cis và 1 liên kết đôi dạng trans.
c. Trên phổ hồng ngoại (IR), ALA có peak đặc trưng tại số sóng 3300 – 3500 cm⁻¹.
d. Nếu ALA được sản xuất dưới dạng viên uống bổ sung thì cách sử dụng đúng sẽ là mở viên lấy dịch trong viên hòa tan trong nước thành dung dịch đồng nhất rồi uống.
Câu 2. Serotonin là một neurotransmitter quan trọng trong hệ thần kinh, đóng vai trò trong việc điều chỉnh tâm trạng, giấc ngủ, và chức năng tiêu hóa. Nó tác động lên các thụ thể serotonin trên bề mặt các tế bào thần kinh để gây ra các hiệu ứng sinh học như cải thiện tâm trạng và điều hòa chức năng tiêu hóa. Sự mất cân bằng trong hàm lượng serotonin liên quan đến các rối loạn như trầm cảm và lo âu. Công thức cấu tạo của serotonin như hình sau đây: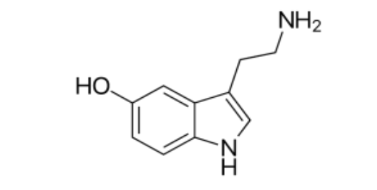 a. Công thức phân tử của serotonin là C₁₀H₁₂N₂O.
a. Công thức phân tử của serotonin là C₁₀H₁₂N₂O.
b. Serotonin là một amine bậc 2, khi phân tích serotonin bằng phổ khối lượng, tín hiệu ion phân tử serotonin có giá trị m/z là 176.
c. Serotonin có thể phản ứng với HCl tạo muối, đây cũng là dạng hợp chất được sử dụng trong các dược phẩm chứa serotonin vì dễ tan trong nước hơn.
d. Trong ngành công nghiệp hữu cơ, người ta có thể tạo các muối diazonium từ phản ứng của serotonin với nitrous acid.
Câu 3. Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào 3 ống nghiệm, mỗi ống 2 ml dung dịch H₂SO₄ 1 M.
Bước 2: Cho 3 lá kim loại có kích thước như nhau gồm lá nhôm (aluminium, Al) đã làm sạch lớp bề mặt vào ống nghiệm (1), lá sắt (iron, Fe) vào ống nghiệm (2) và lá đồng (coper, Cu) vào ống nghiệm (3). Biết: E⁰Al³⁺/Al = −1,676 V ; E⁰Fe²⁺/Fe = −0,440 V; E⁰Cu²⁺/Cu = +0,340 V
a. Ở bước 2, ở cả ba ống nghiệm đều có khí thoát ra.
b. Tốc độ thoát khí ở ống (1) nhanh hơn ống (2).
c. Nếu thay H₂SO₄ loãng bằng H₂SO₄ đặc thì hiện tượng ở bước 2 sẽ không đổi.
d. Nếu thay ống nghiệm chứa lá nhôm (Al) bằng lá kẽm (Zn), thì tốc độ thoát khí ở ống mới sẽ chậm hơn so với ống chứa lá nhôm, nhưng nhanh hơn so với ống chứa lá sắt (Fe) (biết thế điện cực chuẩn của kẽm là −0,763 V).
Câu 4. Việc tái chế chi từ pin cũ là một quá trình quan trọng trong việc quản lý chất thải điện tử và bảo vệ môi trường. Đầu tiên, các pin cũ được thu gom từ nhiều nguồn khác nhau như thiết bị điện tử hỏng hóc hay các hệ thống năng lượng mặt trời cũ. Sau đó, chúng được xử lý để tách chất chì ra khỏi các thành phần khác như nhựa và kim loại, thông qua các phương pháp hóa học và cơ học phù hợp. Chỉ sau khi được tách ra được tinh lọc và làm sạch để chuẩn bị cho quá trình tái sử dụng. Chì tái chế có thể được sử dụng lại để sản xuất pin mới hoặc để chế tạo thành các sản phẩm khác như vật liệu chống cháy và hợp kim chì. Quá trình này không chỉ giúp giảm thiểu lượng chất thải điện tử mà còn tiết kiệm tài nguyên và năng lượng so với việc khai thác chì từ quặng mỏ, đồng thời đảm bảo an toàn môi trường và sức khỏe con người. a. Việc tái chế chì từ pin cũ giúp tiết kiệm tài nguyên và năng lượng so với việc khai thác chì từ quặng mỏ.
a. Việc tái chế chì từ pin cũ giúp tiết kiệm tài nguyên và năng lượng so với việc khai thác chì từ quặng mỏ.
b. Trong quá trình tái chế, chì kim loại được tách ra thông qua quá trình điện phân dung dịch chì (II) sulfate (PbSO₄).
c. Trong pin cũ, chì thường tồn tại dưới dạng chì (IV) oxide (PbO₂). Trong quá trình tái chế, chì (IV) oxide (PbO₂) và các hợp chất chì khác được khử thành chì kim loại thông qua các phản ứng hóa học, thường là bằng cách sử dụng các tác nhân khử như carbon.
d. Tái chế chì từ pin cũ có thể dẫn đến việc phát thải các hợp chất độc hại như chì (II) nitrate (Pb(NO₃)₂) nếu quy trình không được kiểm soát đúng cách.
PHẦN III: TRẢ LỜI NGẮN. Thí sinh trả lời từ câu 1 đến câu 6
Câu 1: Cho amino acid có công thức phân tử là C₄H₉NO₂. Số đồng phân α-amino acid là bao nhiêu?
Câu 2: Cho các chất sau: glucose; fructose; saccharose; maltose; ethyl formate; methyl acetate. Số chất có khả năng tham gia phản ứng tráng bạc là bao nhiêu?
Câu 3: Khi thủy phân hoàn toàn một chất béo B bằng dung dịch NaOH, thì thu được một muối là C₁₅H₃₁COONa. Phân tử khối của E là bao nhiêu?
Câu 4: Tính khối lượng Al₂O₃ cần dùng để điều chế được 13,5 tấn nhôm (Aluminum, Al) bằng phương pháp điện phân nóng chảy. Biết hiệu suất của cả quá trình là 80%. (Làm tròn đến hang phần mười).
Câu 5: Một loại cao su lưu hoá chứa 1,714% sulfur. Hỏi cứ khoảng bao nhiêu mắt xích isoprene có một cầu nối disulfide –S–S– (giả thiết rằng S đã thay thế cho H ở nhóm methylene trong mạch cao su)?
Câu 6: Protein có vai trò quan trọng đối với sự sống của người và sinh vật, protein là cơ sở tạo nên sự sống, duy trì, phát triển và bảo vệ cơ thể.
a. Một số protein đóng vai trò là enzyme xúc tác cho nhiều phản ứng sinh hóa.
b. Protein là một trong những nguồn thức ăn chính bổ sung các amino acid thiết yếu và năng lượng cho cơ thể.
c. Protein cũng đóng vai trò quan trọng trong việc duy trì pH của máu.
d. Một số protein có vai trò bảo vệ, chống lại các tác nhân gây bệnh như vi khuẩn, virut, …
Số phát biểu đúng là bao nhiêu?
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ vào các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức với các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Sử dụng kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh cho các cơ sở giáo dục đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương cũng như trên phạm vi cả nước, làm cơ sở điều chỉnh nội dung, phương pháp giảng dạy trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo, thí sinh dự thi Tốt nghiệp THPT năm 2025 bắt buộc phải tham gia ba bài thi: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh sẽ chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học và Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí và Giáo dục công dân (đối với học sinh học chương trình GDPT).
Môn Hóa học là một trong ba môn thành phần của bài thi tổ hợp KHTN. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học nếu không chọn bài thi KHTN, trừ khi môn này phục vụ mục tiêu xét tốt nghiệp hoặc đăng ký vào các ngành đại học, cao đẳng yêu cầu môn Hóa.
Vì vậy, Đề thi thử tốt nghiệp THPT 2025 môn Hóa học – Đề 13 là tài liệu tham khảo hữu ích dành cho những thí sinh lựa chọn tổ hợp KHTN. Đề giúp các em ôn tập kiến thức, rèn luyện kỹ năng làm bài, đồng thời đánh giá được năng lực hiện tại để chuẩn bị tốt cho kỳ thi chính thức.




