Đề thi thử Đại học 2025 môn Hóa học – Đề 18 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề số 18 được xây dựng với mục tiêu bám sát định hướng đổi mới của Bộ GD&ĐT năm 2025, đảm bảo giúp học sinh lớp 12 ôn luyện đúng trọng tâm và chuẩn kỹ năng làm bài trắc nghiệm hóa học. Cấu trúc đề thi được phân chia hợp lý từ nhận biết – thông hiểu đến vận dụng – vận dụng cao, xoay quanh các chuyên đề chủ chốt như: Cấu tạo chất – bảng tuần hoàn, phản ứng oxi hóa – khử – điện phân, kim loại và hợp chất, hidrocacbon – dẫn xuất – hợp chất chứa nhóm chức, este – lipit – gluxit, amino axit – protein – peptit, và các bài toán thực nghiệm – đồ thị.
Những điểm học sinh cần chú trọng khi luyện đề 18:
- Nắm chắc các công thức, định luật bảo toàn và kỹ thuật giải nhanh.
- Luyện kỹ năng phân tích, xử lý số liệu, biểu đồ và đồ thị trong các câu hỏi thực nghiệm.
- Vận dụng linh hoạt kiến thức tổng hợp giữa hóa học vô cơ và hữu cơ.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 – ĐỀ 18




PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Kí hiệu nào sau đây biểu diễn đúng với cặp oxi hoá – khử?
A. Cu/Cu²⁺.
B. 2I⁻/I₂.
C. Cu²⁺/Cu.
D. Fe₂O₃/FeO.
Câu 2. Sodium hydrogencarbonate là chất được dùng làm bột nở, chế thuốc giảm đau dạ dày do thừa axit. Công thức của sodium hydrogencarbonate là
A. NaOH.
B. NaHS.
C. NaHCO₃.
D. Na₂CO₃
Câu 3. Poly(vinyl chloride) có công thức là
A. {-CH₂ – CH₂ -}ₙ
B. {-CH₂ –CH = CH – CH₂ -}ₙ
C. {- CH₂ –CHCl-}ₙ
D. {-CH₂ –CCl = CH – CH₂ -}ₙ
Câu 4. Kim loại có các tính chất vật lý chung là
A. Tính dẻo, tính dẫn điện, tính dẫn nhiệt, ánh kim.
B. Tính dẫn điện, tính dẫn nhiệt, ánh kim, tính đàn hồi.
C. Tính dẻo, tính dẫn điện, tính khó nóng chảy, ánh kim.
D. Tính dẻo, tính dẫn điện, tính dẫn nhiệt, tính cứng.
Câu 5. Nguyên tố Na (Sodium) có số hiệu nguyên tử là 11 . Ở trạng thái cơ bản, cấu hình electron của ion Na⁺ là
A. 1s²2s²2p⁶3s¹.
B. 1s²2s²2p⁶3s².
C. 1s²2s²2p⁶3s²3p⁶4s¹.
D. 1s²2s²2p⁶.
Câu 6. Hóa chất nào sau đây không sử dụng để làm mềm nước cứng tạm thời?
A. Na₂CO₃.
B. Na₃PO₄.
C. Ca(OH)₂ vừa đủ.
D. H₂SO₄.
Câu 7. Các biện pháp để phòng nguy cơ cháy nổ từ các thiết bị điện trong gia đình. Cho các phát biểu sau:
(a) Tắt bàn là, bếp điện, máy sấy tóc sau khi sử dụng và để cách xa các vật liệu dễ cháy.
(b) Sử dụng thiết bị điện đúng công suất, cầu dao điện đảm bảo tiếp xúc điện tốt, có sự giám sát khi sử dụng các thiết bị có nhiệt độ cao như lò đốt, lò nung.
(c) Giữa nguyên các thiết bị điện ô tô, xe máy theo đúng thiết kế của nhà sản xuất.
Các phát biểu đúng là
A. (a), (b), (c).
B. (a), (b).
C. (b), (c).
D. (a), (c).
Câu 8. Phú dưỡng là hiện tượng
A. Ao, hồ dư quá nhiều các nguyên tố dinh dưỡng.
B. Ao, hồ thiếu quá nhiều các nguyên tố dinh dưỡng.
C. Ao, hồ dư quá nhiều các nguyên tố kim loại nặng.
D. Ao, hồ thiếu quá nhiều các nguyên tố kim loại nặng.
Câu 9. Phổ khối lượng (MS) là phương pháp hiện đại để xác định phân tử khối của các hợp chất hữu cơ. Kết quả phân tích phổ khối lượng cho thấy phân tử khối của hợp chất hữu cơ X là 88 . Chất X có thể là
A. acetic acid.
B. ethyl acetate.
C. acetone.
D. trimethylamine.
Câu 10. Phản ứng thủy phân ethyl acetate trong môi trường acid hoặc kiềm được gọi là phản ứng
A. thủy phân ester.
B. trùng hợp.
C. trung hòa.
D. trùng ngưng.
Câu 11. Công thức cấu tạo thu gọn của methylamine là
A. CH₃ – NH₂ .
B. CH₃ –NH – CH₃ .
C. CH₃ – NH – CH₂ – CH₃ .
D. CH₃ – CH₂ – NH₂ .
Câu 12. Chất nào sau đây thuộc loại disaccharide?
A. Glucose.
B. Saccharose.
C. Tinh bột.
D. Cellulose.
Câu 13. Phương trình hoá học của phản ứng hydrate hóa ethylene để điều chế ethanol là: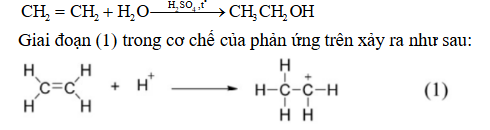 Nhận định nào sau đây không đúng?
Nhận định nào sau đây không đúng?
A. Phản ứng hydrate hóa ethylene là phản ứng cộng.
B. Trong giai đoạn (1) có sự phân cắt liên kết π.
C. Trong giai đoạn (1) có sự hình thành liên kết σ.
D. Trong phân tử ethylene có 6 liên kết σ.
Câu 14. Tên gọi của ester CH₃COOC₂H₅ là
A. ethyl acetate.
B. methyl propionate.
C. ethyl propionate.
D. methyl acetate.
Câu 15. “Amino acid là hợp chất hữu cơ tạp chức, trong phân tử chứa đồng thời nhóm chức … (1) … và nhóm chức … (2) …”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A. carboxyl (–COOH) , amino (–NH₂) .
B. hydroxyl (–OH), amino (–NH₂) .
C. hydroxyl (–OH), amino (–NH₂) .
D. carbonyl (–CO–), carboxyl (–COOH) .
Câu 16. Cho vào ống nghiệm 1mL dung dịch NaOH 30% và 1 giọt dung dịch CuSO₄ 2%, tiếp theo 1mL dung dịch lòng trắng trứng 10%. Lắc nhẹ ống nghiệm, hiện tượng quan sát được là
A. Có kết tủa xanh lam, sau đó kết tủa chuyển sang màu đỏ gạch.
B. Có kết tủa xanh lam, sau đó tạo dung dịch màu tím.
C. Có kết tủa xanh lam, sau đó tan ra tạo dung dịch màu xanh lam.
D. Có kết tủa xanh lam, kết tủa không bị tan.
Câu 17. Sử dụng thông tin ở bảng dưới đây để trả lời câu hỏi: 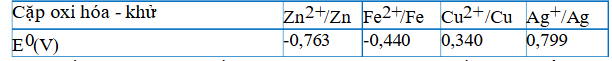 Trong số các ion kim loại gồm Ag⁺, Fe²⁺, Cu²⁺ và Zn²⁺ ở điều kiện chuẩn ion nào có tính oxi hóa yếu hơn Ag⁺, nhưng mạnh hơn Fe²⁺?
Trong số các ion kim loại gồm Ag⁺, Fe²⁺, Cu²⁺ và Zn²⁺ ở điều kiện chuẩn ion nào có tính oxi hóa yếu hơn Ag⁺, nhưng mạnh hơn Fe²⁺?
A. Cu²⁺.
B. Fe²⁺.
C. Zn²⁺.
D. Ag⁺.
Câu 18. Sử dụng thông tin ở bảng dưới đây để trả lời câu hỏi: 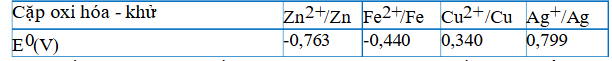 Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa – khử trong số các cặp trên là
Sức điện động chuẩn lớn nhất của pin Galvani thiết lập từ hai cặp oxi hóa – khử trong số các cặp trên là
A. 1,242V.
B. 1,562V.
C. 1,422V.
D. 0.799V.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4 . Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
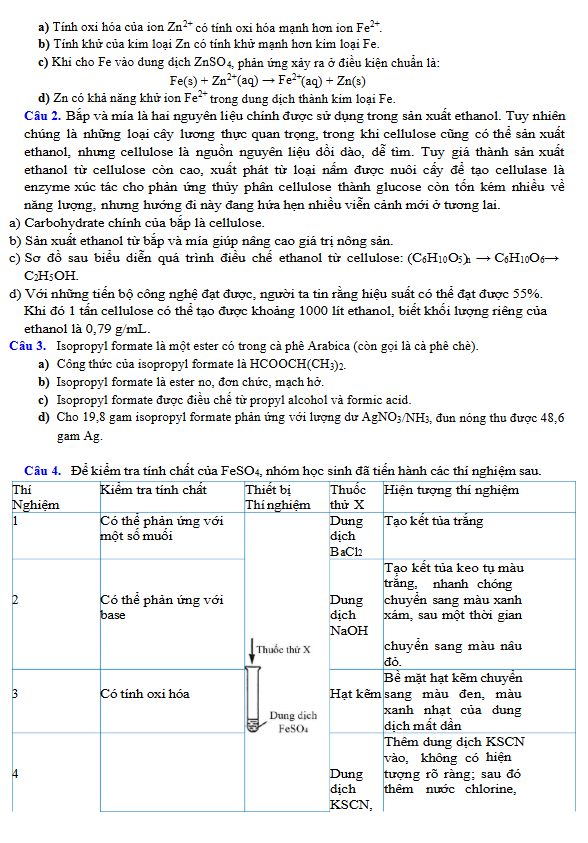
Câu 1. Cho thế điện cực chuẩn của các cặp oxi hóa – khử sau: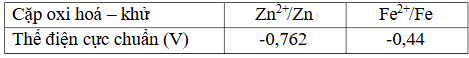 a) Tính oxi hóa của ion Zn²⁺ có tính oxi hóa mạnh hơn ion Fe²⁺.
a) Tính oxi hóa của ion Zn²⁺ có tính oxi hóa mạnh hơn ion Fe²⁺.
b) Tính khử của kim loại Zn có tính khử mạnh hơn kim loại Fe.
c) Khi cho Fe vào dung dịch ZnSO₄, phản ứng xảy ra ở điều kiện chuẩn là:
Fe(s) + Zn²⁺(aq) → Fe²⁺(aq) + Zn(s)
d) Zn có khả năng khử ion Fe³⁺ trong dung dịch thành kim loại Fe.
Câu 2. Bắp và mía là hai nguyên liệu chính được sử dụng trong sản xuất ethanol. Tuy nhiên chúng là những loại cây lương thực quan trọng, trong khi cellulose cũng có thể sản xuất ethanol, nhưng cellulose là nguồn nguyên liệu dồi dào, dễ tìm. Tuy giá thành sản xuất ethanol từ cellulose còn cao, xuất phát từ loại nấm được nuôi cấy để tạo cellulase là enzyme xúc tác cho phản ứng thủy phân cellulose thành glucose còn tốn kém nhiều về năng lượng, nhưng hướng đi này đang hứa hẹn nhiều viễn cảnh mới ở tương lai.
a) Carbohydrate chính của bắp là cellulose.
b) Sản xuất ethanol từ bắp và mía giúp nâng cao giá trị nông sản.
c) Sơ đồ sau biểu diễn quá trình điều chế ethanol từ cellulose: (C₆H₁₀O₅)ₙ → C₆H₁₂O₆→ C₂H₅OH.
d) Với những tiến bộ công nghệ đạt được, người ta tin rằng hiệu suất có thể đạt được 55%. Khi đó 1 tấn cellulose có thể tạo được khoảng 1000 lít ethanol, biết khối lượng riêng của ethanol là 0,79 g/mL.
Câu 3. Isopropyl formate là một ester có trong cà phê Arabica (còn gọi là cà phê chè).
a) Công thức của isopropyl formate là HCOOCH(CH₃)₂.
b) Isopropyl formate là ester no, đơn chức, mạch hở.
c) Isopropyl formate được điều chế từ propyl alcohol và formic acid.
d) Cho 19,8 gam isopropyl formate phản ứng với lượng dư AgNO₃/NH₃, đun nóng thu được 48,6 gam Ag.
Câu 4. Để kiểm tra tính chất của FeSO₄, nhóm học sinh đã tiến hành các thí nghiệm sau.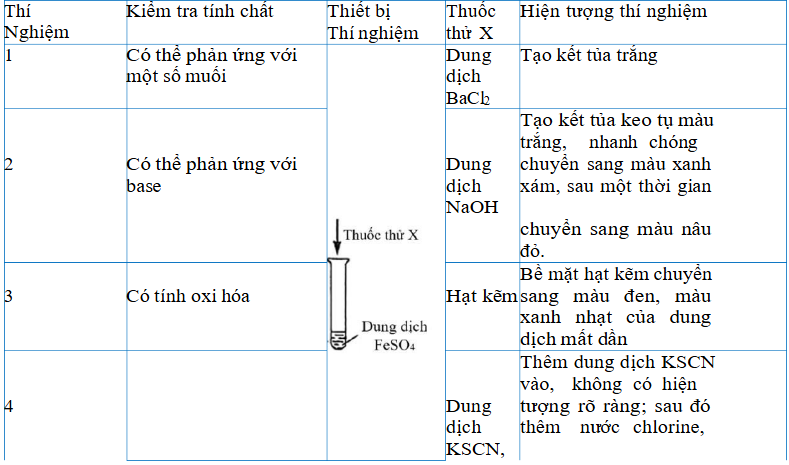

Kết thúc thí nghiệm, nhóm học sinh dự đoán “thí nghiệm 4 chứng minh FeSO₄ không có tính khử”.
Cho biết: Fe³⁺ + 3SCN⁻ → Fe(SCN)₃ (dung dịch màu đỏ máu)
a) Nguyên nhân hình thành kết tủa trắng trong thí nghiệm 1: Ba²⁺ + SO₄²⁻ → BaSO₄.
b) Nguyên nhân kết tủa trong thí nghiệm 2 chuyển sang màu nâu đỏ: 4Fe(OH)₂ + O₂ + 2H₂O → 4Fe(OH)₃.
c) Trong thí nghiệm 3, thay thế hạt kẽm bằng dải magnesium (đã đánh bóng) cũng có thể chứng minh FeSO₄ có tính oxi hóa.
d) Từ kết quả thí nghiệm, kết luận được dự đoán của nhóm học sinh là chính xác.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Một số phế liệu được dùng để tái chế nhôm:
(1) vỏ lon bia, vỏ lon nước ngọt;
(2) giấy nhôm và khay nướng bằng nhôm;
(3) rổ, thau, chậu, nồi, mâm nhôm cũ;
(4) thanh treo đồ, móc quần áo cũ; đầu xi lanh xe hơi;
(5) hệ thống cáp điện;
(6) Chai nhựa;
(7) Ghế ngồi, bàn ăn làm bằng inox;
Số phát biểu đúng bao nhiêu?
Câu 2. Đun nóng một triglyceride với dung dịch KOH , sản phẩm thu được có chứa muối potassium stearate (C₁₇H₃₅COOK). Phân tử khối của potassium stearate là bao nhiêu? (cho biết: C:12; H:1; O:16; K:39)
Câu 3. Cho phương trình hóa học của các phản ứng được đánh số thứ tự từ 1 tới 4 dưới đây:
(1) (C₆H₁₀O₅)ₙ (tinh bột) +nH₂O -(H⁺, t⁰)→ nC₆H₁₂O₆ (glucose)
(2) C₆H₁₂O₆ (glucose) -(enzyme)→ 2C₂H₅OH + 2CO₂
(3) C₆H₁₂O₆ (glucose) → 2CH₃CH(OH)COOH
(4) C₆H₁₂O₆ (glucose) +2 [Ag(NH₃)₂]OH -(t⁰)→ CH₂OH(CHOH)₄COONH₄ + 2Ag + 3NH₃ + H₂O
Gắn số thứ tự phương trình hóa học các phản ứng theo tên gọi: Lên men rượu, thủy phân, lên men lactic, tráng gương và sắp xếp theo thứ tự từ (ví dụ: 1234,4321 ….)
Câu 4. Có bao nhiêu phát biểu đúng trong các phát biểu sau?
(a) C₆H₅NH₂ có tên thay thế là aniline.
(b) Glycine (H₂NCH₂COOH) phản ứng được với dung dịch NaOH.
(c) Phân tử lysine có một nguyên tử nitrogen.
(d) Trong môi trường kiềm, dạng tồn tại chủ yếu của glycine là dạng cation
(e) Khi ăn các loại thực phẩm như thịt, cá, trứng…. hệ tiêu hoá giúp chuyển hoá protein thành α-amino acid.
(f) “Gạch cua” nổi lên khi nấu riêu cua là hiện tượng đông tụ protein.
(g) Aniline thường được sử dụng làm sản xuất phẩm nhuộm, dược phẩm
Câu 5. Trong một nhà máy sản xuất ammonia theo quy trình Haber, giai đoạn sản xuất khí hydrogen bằng phản ứng của methane và nước được thực hiện theo phương trình hóa học (1) như sau:
(1) CH₄(g)+ H₂O(g) → CO(g)+ 3H₂(g)
Phản ứng (1) là phản ứng thu nhiệt mạnh. Lượng nhiệt này được cung cấp từ quá trình đốt cháy hoàn toàn khí methane theo phương trình hóa học (2):
(2) CH₄(g) + 2O₂(g) →CO₂(g)+ 2H₂O(g)
Xét các phản ứng ở điều kiện chuẩn và hiệu suất chuyển hóa của methane là 100% . Tính khối lượng khí methane (theo tấn, làm tròn đến hàng phần trăm) cần thiết để sản xuất 0,30 tấn H₂(g) trong giai đoạn trên. Biết 90% lượng nhiệt tỏa ra từ phản ứng (2) được cung cấp cho phản ứng (1) và các giá trị nhiệt tạo thành (ΔfH⁰₂₉₈) của các chất ở điều kiện chuẩn được cho trong bảng sau: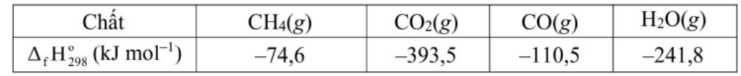
Câu 6. Cisplatin là thế hệ đầu tiên trong số ba phức chất của Pt²⁺ được sử dụng trong điều trị ung thư. Nó được biết đến với vai trò to lớn trong điều trị ung thư buồng trứng, tinh hoàn, bàng quang, đầu, cổ,… Nhờ có cisplatin hơn 90% bệnh nhân ung thư tinh hoàn đã được cứu sống. Cisplatin có thể được điều chế theo sơ đồ sau: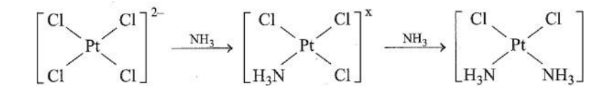 Giá trị của X là bao nhiêu?
Giá trị của X là bao nhiêu?
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các cơ sở giáo dục đại học, cao đẳng tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên cả nước, làm cơ sở để điều chỉnh nội dung, phương pháp dạy học trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 phải tham gia 3 bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Bên cạnh đó, thí sinh cần chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí và Giáo dục công dân (dành cho học sinh theo chương trình giáo dục phổ thông hiện hành).
Trong bài thi tổ hợp KHTN, môn Hóa học là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học, trừ khi lựa chọn tổ hợp KHTN để xét tốt nghiệp hoặc phục vụ mục đích xét tuyển đại học, cao đẳng vào các ngành có yêu cầu môn Hóa học.
Chính vì vậy, Đề thi thử tốt nghiệp THPT 2025 môn Hóa học – Đề 18 do Sở Giáo dục và Đào tạo Hải Dương biên soạn là tài liệu hữu ích cho các thí sinh lựa chọn tổ hợp KHTN. Đề thi giúp học sinh ôn luyện kiến thức, đánh giá năng lực bản thân và rèn luyện kỹ năng làm bài, từ đó chuẩn bị thật tốt cho kỳ thi chính thức.




