Đề thi thử Đại học 2025 môn Hóa học – Đề 6 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề 6 tiếp tục là một đề thi chất lượng trong chuỗi luyện thi thử môn Hóa học năm 2025, được thiết kế bám sát theo chuẩn cấu trúc đề minh họa mới nhất của Bộ Giáo dục và Đào tạo, với mục tiêu giúp học sinh lớp 12 nâng cao khả năng tư duy, kỹ năng giải bài và phân tích dữ kiện hóa học.
Đề thi gồm 40 câu trắc nghiệm, với các nội dung bao trùm toàn bộ chương trình Hóa học THPT, đặc biệt là lớp 12, cụ thể:
- Phần Hóa học vô cơ: kiến thức về kim loại, phản ứng hóa học của các chất vô cơ, dãy điện hóa, phương pháp điện phân, bài toán kết tủa, bài tập oxi hóa – khử.
- Phần Hóa học hữu cơ: đặc điểm và phản ứng đặc trưng của các chất như este, ancol, axit cacboxylic, amin, amino axit, peptit, và các chuỗi chuyển hóa hữu cơ.
- Dạng bài thực hành và thực tiễn: nhận biết hóa chất, xử lý số liệu bảng biểu, đồ thị, sơ đồ phản ứng tổng hợp, các phản ứng trong phòng thí nghiệm và đời sống.
Đề số 6 có sự phân hóa rõ rệt, từ câu hỏi cơ bản đến các câu vận dụng – vận dụng cao, giúp học sinh không chỉ rèn luyện kiến thức mà còn làm quen với tư duy xử lý đề theo hướng mới, đặc biệt phù hợp với các bạn muốn đạt mục tiêu 8 – 10 điểm.
Hãy cùng Dethitracnghiem.vn cùng tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ – ĐỀ 6






PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18 . Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1. Tiến hành thí nghiệm (như hình vẽ): cho dung dịch NaCl bão hòa vào cốc 1, cốc 2, cốc 3; cho dầu nhờn vào cốc 4. Thêm vào cốc 1 và cốc 4 một đinh sắt sạch, cho vào cốc 2 đinh sắt sạch được quấn bởi dây Zn, cho vào cốc 3 đinh sắt sạch được quấn bởi dây Cu. Để 4 cốc trong không khí khoảng 5 ngày.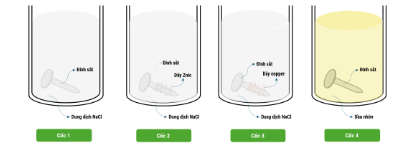 Cho các phát biểu về hiện tượng quan sát được trong 4 cốc như sau:
Cho các phát biểu về hiện tượng quan sát được trong 4 cốc như sau:
(1). Ở cốc 4, đinh sắt không bị gỉ (không bị ăn mòn).
(2). Ở cốc 2, đinh sắt không bị gỉ, dây Zn bị ăn mòn và có khí thoát ra.
(3). Ở cốc 3, đinh sắt bị gỉ nhiều nhất và dây đồng không bị ăn mòn.
(4). Ở cốc 1, đinh sắt bị gỉ và dung dịch có màu vàng của FeCl₃
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 2. Ở một số quốc gia, khoáng vật trona là nguyên liệu chính để sản xuất soda. Thành phần hóa học chính của trona là
A. 3NaF.AlF₃.
B. NaCl.KCl.
C. Na₂CO₃.NaHCO₃.2H₂O.
D. NaNO₃.
Câu 3. Hình dưới đây là ký hiệu của 6 polymer nhiệt dẻo phổ biến có thể tái chế: Các ký hiệu này thường được in trên bao bì, vỏ hộp, đồ dùng…để giúp nhận biết vật liệu polymer cũng như thuận lợi cho việc thu gom, tái chế. Polymer có ký hiệu số 5 được điều chế bằng phản ứng trùng hợp monomer nào dưới đây?
Các ký hiệu này thường được in trên bao bì, vỏ hộp, đồ dùng…để giúp nhận biết vật liệu polymer cũng như thuận lợi cho việc thu gom, tái chế. Polymer có ký hiệu số 5 được điều chế bằng phản ứng trùng hợp monomer nào dưới đây?
A. CH₂=CH₂.
B. CH₂=CH-CH₃.
C. CH₂=CH-C₆H₅.
D. CH₂=CH-Cl.
Câu 4. Hình dưới đây mô tả tính chất vật lí nào của kim loại? (hình tròn to mô tả ion kim loại, hình tròn nhỏ mô tả electron tự do)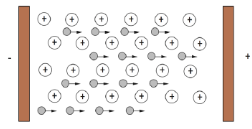 A. Tính dẻo.
A. Tính dẻo.
B. Tính dẫn điện.
C. Tính dẫn nhiệt.
D. Tính cứng.
Câu 5. Nung nóng chất X là các hợp chất vô cơ của một kim loại kiềm, có nhiều ứng dụng trong thực tế và khi đốt nóng ở nhiệt độ cao trên đèn khí cho ngọn lửa màu vàng. Cho các thông tin sau:
+ X tác dụng NaOH sẽ tạo thành Y và H₂O;
+ Nung nóng X thì thu được sản phẩm là Y, chất khí và H₂O
Công thức của hợp chất Y là
A. NaOH.
B. K₂CO₃.
C. Na₂CO₃.
D. NaHCO₃.
Câu 6. Cách nào sau đây không sử dụng để làm mềm nước có tính cứng vĩnh cửu?
A. Dùng dung dịch Na₂CO₃.
B. Đun sôi nước.
C. Dùng dung dịch Na₃PO₄.
D. Dùng phương pháp trao đổi ion.
Câu 7. Điểm chớp cháy là nhiệt độ thấp nhất ở áp suất của khí quyển mà một chất lỏng hoặc vật liệu dễ bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc nguồn lửa.
+ Điểm chớp cháy được sử dụng để phân biệt chất lỏng dễ cháy với chất lỏng có thể gây cháy:
+ Chất lỏng có điểm chớp cháy <37,8°C gọi là chất lỏng dễ cháy.
+Chất lỏng có điểm chớp cháy ≥37,8°C gọi là chất lỏng có thể gây cháy.
Cho bảng số liệu sau: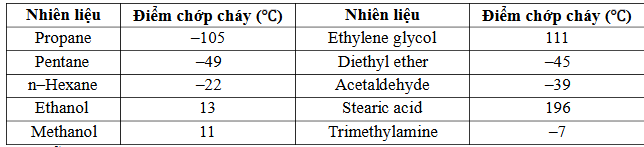 Số chất lỏng dễ cháy trong bảng trên là
Số chất lỏng dễ cháy trong bảng trên là
A. 6.
B. 7.
C. 8.
D. 9.
Câu 8. Trong nông nghiệp, nếu bón nhiều phân superphosphate đơn sẽ làm đất chai cứng. Chất nào sau đây trong phân superphosphate đơn là nguyên nhân chính gây nên hiện tượng chai cứng đất?
A. Ca(H₂PO₄)₂.
B. Ca(H₂PO₄)₂ + CaSO₄.
C. CaSO₄.
D. Ca₃(PO₄)₂.
Câu 9. Cho biểu đồ nhiệt độ sôi (°C) của một số chất như sau: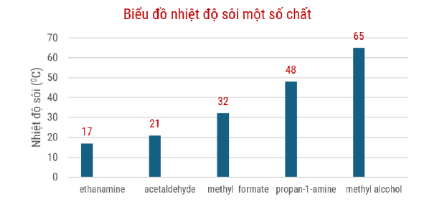 Số chất tồn tại dạng khí ở điều kiện chuẩn (25 °C, 1 bar) là
Số chất tồn tại dạng khí ở điều kiện chuẩn (25 °C, 1 bar) là
A. 1.
B. 2.
C. 4.
D. 5.
Câu 10. Heptanoic acid được ứng dụng trong mỹ phẩm, nước hoa và các ứng dụng tạo mùi thơm. Phổ hồng ngoại của heptanoic acid như sau: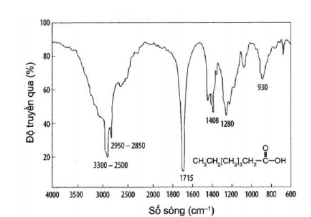 Peak nào giúp dự đoán được trong hợp chất này có nhóm chức carboxyl?
Peak nào giúp dự đoán được trong hợp chất này có nhóm chức carboxyl?
A. peak 3300-2500 cm⁻¹.
B. peak 2950-2850 cm⁻¹.
C. peak 1715 cm⁻¹.
D. peak 1408 cm⁻¹.
Câu 11. Palmitic acid là một acid béo bão hoà phổ biến trong động vật và thực vật. Công thức của palmitic acid là
A. C₁₅H₃₁COOH.
B. HCOOH.
C. C₁₅H₃₁COOH.
D. CH₃COOH.
Câu 12. Trong y học, dung dịch glucose 5% (G-5) là dịch truyền tĩnh mạch cho những trường hợp bệnh nhân thiếu nước và năng lượng theo chỉ định của bác sĩ. Một chai chứa 600 gam dịch truyền G-5 cung cấp được tối đa m (kJ) năng lượng. Giá trị của m là (Biết 1 gam glucose có thể cung cấp 10 kJ năng lượng).
A. 500.
B. 300.
C. 400.
D. 200.
Câu 13. Ethylene là một trong những hóa chất quan trọng, có nhiều ứng dụng trong đời sống: kích thích quả mau chín, điều chế nhựa làm sản phẩm gia dụng,… Phản ứng hóa học của ethylene với dung dịch Br₂ như sau: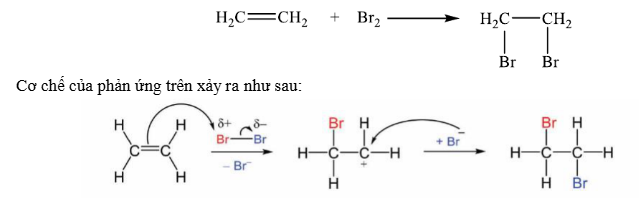
Nhận định nào sau đây không đúng?
A. Phản ứng trên thuộc loại phản ứng cộng.
B. Giai đoạn 1, liên kết đôi phản ứng với tác nhân Br⁺ tạo thành phần tử mang điện dương.
C. Giai đoạn 2, phần tử mang điện dương kết hợp với anionBr⁻ tạo thành sản phẩm.
D. Hiện tượng của phản ứng là dung dịch bromine bị mất màu.
Câu 14. Ester X được tạo bởi methyl alcohol và acetic acid. Công thức của X là
A. HCOOC₂H₅.
B. CH₃COOC₂H₅.
C. CH₃COOCH₃.
D. HCOOCH₃.
Câu 15. Insulin là hocmon có tác dụng điều tiết lượng đường trong máu. Thủy phân một phần phân tử insulin thu được heptapeptide X mạch hở. Khi thủy phân không hoàn toàn X, thu được hỗn hợp chứa các peptide: Phe-Phe-Tyr, Pro-Lys-Thr, Tyr-Thr-Pro, Phe-Tyr-Thr. Nếu đánh số thứ tự từ đầu N là số 1, thì amino acid ở vị trí số 5 trong X có kí hiệu là
A. Thr.
B. Pro.
C. Tyr.
D. Lys.
Câu 16. Tuỳ thuộc vào pH của dung dịch, alanine tồn tại một số dạng như sau: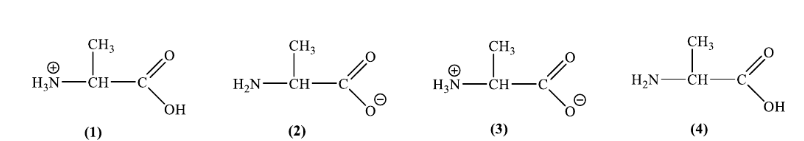
Khi pH = 11 thì alanine sẽ tồn tại dạng nào trong các dạng trên? Cho biết pHi của alanine là 6,01.
A. (1).
B. (2).
C. (3).
D. (4).
Câu 17. Cho thế điện cực chuẩn của các cặp oxi hóa – khử sau: E⁰MnO₄⁻/Mn²⁺ = +1,51 V và E⁰Fe³⁺/Fe²⁺ = +0,77 V
Phát biểu nào sau đây sai?
A. Ion MnO₄⁻ có tính oxi hóa mạnh hơn Fe³⁺.
B. Ion Fe²⁺ có thể bị oxi hóa bởi ion MnO₄⁻.
C. Khi cho Fe(NO₃)₂ vào dung dịch KMnO₄, quá trình oxi hóa xảy ra là: Fe²⁺(aq) + 1e→ Fe³⁺(aq).
D. ion MnO₄⁻ có khả năng oxi hóa ion Fe²⁺ trong dung dịch thành ion Fe³⁺.
Câu 18. Điện phân dung dịch CuSO₄ với điện cực Pt. Theo thời gian, màu xanh của dung dịch CuSO₄ nhạt dần và mất hẳn, đồng thời có khí thoát ra ở hai điện cực. Khí thoát ra ở cathode và anode lần lượt là
A. O₂ và H₂.
B. H₂ và O₂.
C. SO₂ và O₂.
D. H₂ và SO₂.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4 . Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Thí nghiệm điện phân dung dịch copper(II) sulfate với các điện cực trơ (graphite) được mô phỏng như hình vẽ sau đây: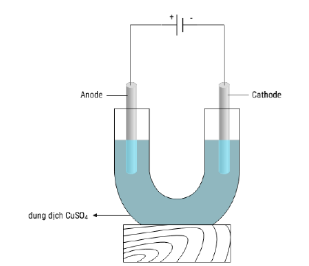
a. Tại anode, xuất hiện bọt khí hydrogen trên bề mặt điện cực.
b. Tại cathode, trước tiên xảy ra sự oxi hóa nước sau đó xảy ra tiếp sự oxi hóa Cu²⁺.
c. Dung dịch sau điện phân có giá trị pH tăng lên.
d. Nếu tiến hành điện phân dung dịch chứa 0,15 mol copper (II) sulfate trong thời gian 38 phút 36 giây với cường độ dòng điện 10A thì khối lượng dung dịch sau phản ứng giảm là 9,6 gam.
Câu 2. Theo Tiêu chuẩn Việt Nam TCVN 7624 : 2007, khi chế tạo gương, chiều dày lớp bạc phủ trên bề mặt tấm kính (quy ra tổng lượng bạc trên một đơn vị m² kính) phải đạt tối thiểu 0,7 g.m⁻². Một công ty cần sản xuất 30000 m² gương có độ dày lớp bạc phủ ở mức 0,72 g.m⁻². Để tạo ra bạc, người ta tiến hành theo sơ đồ phản ứng như sau:
Saccharose —(+H₂O,H⁺,t⁰)→ Dung dịch A —(+NH₃,t⁰)→ Dung dịch B —(+Ag(NH₃)₂OH,t⁰)→ Ag↓
Biết hiệu suất cả quá trình là 80%.
a. Lượng bạc được tráng lên 30 000m² gương với độ dày lớp bạc phủ ở mức 0,72 g.m⁻² là 21,6 kg.
b. Trong dung dịch A có hai loại monosaccharide.
c. Trong quá trình thủy phân saccharose có thể thay xúc tác acid bằng xúc tác base.
d. Để sản xuất lượng gương với độ phủ bạc như trên, công ty đó cần sử dụng lượng saccharose ít nhất là 21,375 kg.
Câu 3. Khảo sát một số tính chất của 3 chất X, Y, Z được ghi lại trong bảng sau: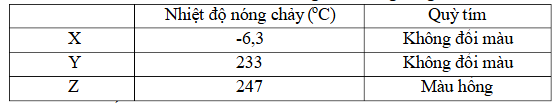
Biết X, Y, Z là một trong 3 chất: Glycine, Aniline, Glutamic acid.
a. Dựa vào nhiệt độ nóng chảy thì chất Y, Z là chất rắn ở nhiệt độ thường.
b. Tên bán hệ thống của glutamic acid là α – amino pentane-1,5-dioic.
c. X, Y, Z lần lượt là Aniline, Glycine, Glutamic acid.
d. Nếu hexapeptide T được tạo bởi Y và Z có phân tử khối là 504 amu thì số gốc Glu trong peptide là 4.
Câu 4. Hai ống nghiệm (1) và (2) đều chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Tiến hành hai thí nghiệm sau ở 20°C:
Thí nghiệm 1: Thêm từ từ cho đến hết 2 mL dung dịch hydrochloric acid đặc (nồng độ khoảng 11 M) không màu vào ống nghiệm (1) thu được dung dịch có màu vàng chanh, do có quá trình:
[Cu(OH₂)₆]²⁺(aq) + 4 Cl⁻(aq) ⇌ [CuCl₄]²⁻(aq) + 6 H₂O(l) Kc = 4,18.10⁵
Thí nghiệm 2: Thêm từ từ cho đến hết 2 mL dung dịch sodium chloride bão hòa (nồng độ khoảng 5,3 M) không màu vào ống nghiệm (2) thu được dung dịch có màu xanh nhạt hơn so với ban đầu.
a. Trong thí nghiệm 1, phức chất [Cu(OH₂)₆]²⁺ bền hơn phức chất [CuCl₄]²⁻.
b. Khi cho dung dịch HCl có nồng độ khoảng 5,3 M vào dung dịch copper(II) sulfate 0,5% thì không quan sát thấy dấu hiệu của phản ứng tạo phức chất [CuCl₄]²⁻.
c. Biểu thức tính hằng số cân bằng của phản ứng ở thí nghiệm 1 là: \( K_c = \dfrac{[[\text{CuCl}_4]^{2-}(\text{aq})]\cdot[\text{H}_2\text{O}(\text{l})]^6}{[[\text{Cu}(\text{OH}_2)_6]^{2+}(\text{aq})]\cdot[\text{Cl}^-(\text{l})]^4} \)
d. Trong thí nghiệm 2, không có dấu hiệu của phản ứng hình thành phức chất.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Một chiếc khuyên tai dạng đĩa tròn mỏng có đường kính 5,00 cm được mạ với lớp phủ vàng dày 0,02 mm từ dung dịch Au³⁺.
Cho:
– Khối lượng riêng của vàng là d = 19,7 g/cm³; π = 3,14.
– F = 96500 C/mol; I = 0,10 A.
Thời gian để mạ vàng cho chiếc khuyên tai là bao nhiêu giờ? (Làm tròn đến hàng phần mười)
Câu 2. Chất béo triolein (C₁₇H₃₃COO)₃C₃H₅) là chất béo thường ở thể lỏng vì trong phân tử chất béo chứa nhiều gốc acid béo không no. Vậy trong chất béo triolein có chứa mấy liên kết π trong phân tử?
Câu 3. Cho các carbohydrate sau: glucose, fructose, saccharose và maltose. Có bao nhiêu carbohydrate có khả năng mở vòng trong dung dịch với dung môi nước?
Câu 4. Hợp chất hữu cơ X (C₅H₁₀O₄N) tác dụng với dung dịch NaOH dư, đun nóng, thu được sản phẩm hữu cơ gồm muối disodium glutamate và alcohol. X có bao nhiêu công thức cấu tạo thỏa mãn?
Câu 5. Các muối carbonate của kim loại nhóm IIA đều bị phân hủy bởi nhiệt:
MCO₃(s) -(t⁰)→ MO (s) + CO₂ (g) ΔrH⁰₂₉₈
Biến thiên enthalpy chuẩn của quá trình trên được cho trong bảng sau: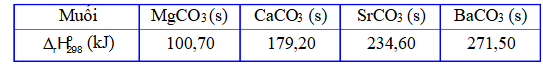 Để sản xuất 1 tấn vôi bột theo phương pháp thủ công, người ta nung đá vôi (có hàm lượng CaCO₃ là 72%, còn lại là tạp chất trơ) với than đá (giả sử chỉ chứa carbon và tạp chất trơ), biết ΔfH⁰₂₉₈(CO₂) = -393,50 kJ/mol. Tính thể tích khí CO₂ tối thiểu đã thải ra môi trường ở điều kiện chuẩn.
Để sản xuất 1 tấn vôi bột theo phương pháp thủ công, người ta nung đá vôi (có hàm lượng CaCO₃ là 72%, còn lại là tạp chất trơ) với than đá (giả sử chỉ chứa carbon và tạp chất trơ), biết ΔfH⁰₂₉₈(CO₂) = -393,50 kJ/mol. Tính thể tích khí CO₂ tối thiểu đã thải ra môi trường ở điều kiện chuẩn.
Câu 6. Để xác định hàm lượng muối Fe(II) trong 1 mẫu dung dịch A có thể dùng dung dịch thuốc tím KMnO₄, phương trình ion như sau:
MnO₄⁻ + 5Fe²⁺ + 8H⁺ → Mn²⁺ + 5Fe³⁺ + 4H₂O
+ Người ta lấy 25,00 mL dung dịch A cho vào bình định mức, thêm nước cất cho đủ 100 mL, dung dịch thu được gọi là dung dịch X.
+ Lấy 10,00 mL từ dung dịch X chuyển vào bình tam giác. Thêm khoảng 5mL dung dịch H₂SO₄ 2M.
+ Tiến hành chuẩn độ 3 lần bằng dung dịch KMnO₄ 0,02M.
Kết quả thể tích KMnO₄ sau 3 lần chuẩn độ lần lượt là 20,50 mL; 20,55 mL; 20,55 mL.
Tính hàm lượng muối Fe²⁺ (g/L) trong dung dịch A
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức với các mục đích chính như sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Sử dụng kết quả thi làm căn cứ xét công nhận tốt nghiệp THPT và tuyển sinh vào các cơ sở giáo dục đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục ở các địa phương và trên cả nước, từ đó làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh tham dự kỳ thi Tốt nghiệp THPT năm 2025 phải thi 3 bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, các em phải chọn một trong hai bài thi tổ hợp sau:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm Vật lí, Hóa học và Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm Lịch sử, Địa lí và Giáo dục công dân (dành cho học sinh chương trình GDPT hiện hành).
Trong bài thi tổ hợp KHTN, môn Hóa học là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học, trừ khi đã lựa chọn tổ hợp KHTN để xét tốt nghiệp hoặc phục vụ mục tiêu xét tuyển vào đại học, cao đẳng đối với các ngành có yêu cầu môn Hóa học.
Chính vì vậy, Đề thi thử tốt nghiệp THPT 2025 môn Hóa học – Đề 6 là tài liệu ôn tập quan trọng dành cho những thí sinh lựa chọn tổ hợp KHTN. Đề thi giúp các em rèn luyện kỹ năng làm bài, tự đánh giá năng lực và chuẩn bị một cách hiệu quả cho kỳ thi chính thức sắp tới.




