Đề thi thử Đại học 2025 môn Hóa học – Sở GD Cao Bằng là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi bám sát cấu trúc đề minh họa năm 2025 của Bộ GD&ĐT, bao phủ các chuyên đề trọng tâm như: este – lipit, amino axit – protein, polime, kim loại, phản ứng hóa học và bài toán bảo toàn. Với độ phân hóa hợp lý, đề giúp học sinh rèn luyện kỹ năng giải nhanh, chính xác và củng cố kiến thức một cách hiệu quả.
Hãy cùng Dethitracnghiem.vn thử sức với đề thi này ngay hôm nay!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GD CAO BẰNG




Cho biết nguyên tử khối: C = 12; H = 1; O = 16; N = 14; S = 32; Cl = 35,5; Na = 23; K = 39; Ca = 40; Mn = 55; Fe = 56; Cu = 64.
PHẦN I. TRẮC NGHIỆM (18 câu)
Câu 1. Chất sinh ra từ sự thủy phân hoàn toàn tinh bột trong môi trường axit là:
A. Fructose.
B. Saccharose.
C. Cellulose.
D. Glucose.
Câu 2. Một mẫu nước tự nhiên có chứa lượng lớn các ion: Ca²⁺, Mg²⁺, HCO₃⁻, Cl⁻. Mẫu nước trên thuộc loại nước gì?
A. Nước có tính cứng vĩnh cửu.
B. Nước có tính cứng tạm thời.
C. Nước có tính cứng toàn phần.
D. Nước mềm.
Câu 3. Số lượng phối tử trong công thức [PtCl₂(NH₃)₂][Fe(CO)₅] là:
A. 1 và 2.
B. 4 và 5.
C. 5 và 6.
D. 5 và 2.
Câu 4. Chất X có công thức CH₂NH₂. Tên gọi của X là:
A. Dimethylamine.
B. Methylamine.
C. Aniline.
D. Trimethylamine.
Câu 5. Để kiểm tra sự có mặt của cation Cu²⁺ hoặc Fe³⁺ trong dung dịch người ta tiến hành các thí nghiệm sau:
Thí nghiệm 1: Cho khoảng 2-3 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 2 mL dung dịch CuSO₄ 1M.
Thí nghiệm 2: Cho khoảng 2-3 giọt dung dịch NaOH vào ống nghiệm chứa khoảng 2 mL dung dịch FeCl₃ 1M.
Nhận xét nào sau đây sai?
A. Có thể thay thế dung dịch NaOH bằng dung dịch KOH trong hai thí nghiệm trên.
B. Ở thí nghiệm thứ nhất xuất hiện kết tủa màu xanh lam.
C. Ở thí nghiệm thứ hai xuất hiện kết tủa màu trắng.
D. Hai thí nghiệm xuất hiện kết tủa khác màu.
Câu 6. Điểm chớp cháy là nhiệt độ thấp nhất mà ở đó chất lỏng bay hơi tạo thành lượng hơi đủ để bốc cháy trong không khí khi tiếp xúc nguồn lửa. Điểm chớp cháy được sử dụng để phân biệt các chất lỏng dễ cháy với chất lỏng có thể gây cháy. Chất lỏng có điểm chớp cháy nhỏ hơn 37,8 °C được gọi là chất lỏng dễ cháy, chất lỏng có điểm chớp cháy lớn hơn 37,8 °C được gọi là chất lỏng có thể gây cháy. Cho bảng số liệu sau:

Trong bảng trên, số chất lỏng dễ cháy là:
A. 3.
B. 5.
C. 6.
D. 4.
Câu 7. Phổ khối lượng (phổ MS) của chất X như sau: 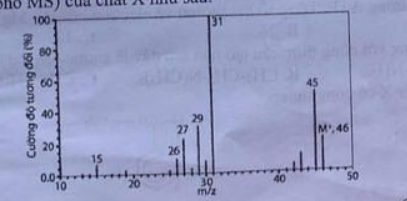
Chất X có thể là
A. benzene.
B. acid acetic.
C. methyl acetate.
D. ethanol.
Câu 8. Acid glutamic có các dạng ion tại giá trị pH mà dạng ion tại đó là chủ yếu (= 100%) như sau: 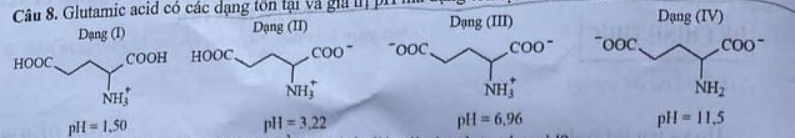

Phát biểu nào sau đây là đúng khi nói về quá trình điện di của acid glutamic?
A. Với môi trường pH = 1,50 thì dạng (I) hầu như không di chuyển.
B. Với môi trường pH = 6,96 thì dạng (III) hầu như không di chuyển.
C. Với môi trường pH = 11,50 thì dạng (IV) di chuyển về cực âm.
D. Với môi trường pH = 1,50 thì dạng (I) di chuyển về cực dương.
Câu 9. Monolaurin là hợp chất có tác dụng kháng khuẩn, kháng virus và kháng vi trùng khác trong ống nghiệm. Công thức cấu tạo của monolaurin như sau:
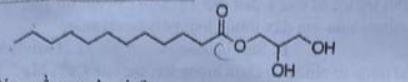
Nhận xét nào sau đây là đúng về monolaurin?
A. Gốc acid trong monolaurin là C₁₁H₂₃COO⁻.
B. Monolaurin là hợp chất hữu cơ tạp chức.
C. Monolaurin có 16 nguyên tử C.
D. Monolaurin tham gia phản ứng với dung dịch NaOH tạo ra sản phẩm có chứa glycerol.
Câu 10. Muối nào khi tan trong nước tạo ra dung dịch có phản ứng kiềm?
A. Na₂CO₃.
B. MgCl₂.
C. KCl.
D. HCl.
Câu 11. Khi điện phân dung dịch NaCl (có màng ngăn) quá trình xảy ra ở cực âm là:
A. 2H₂O + 2e → H₂ + 2OH⁻.
B. Na⁺ + e → Na.
C. 2Cl⁻ → Cl₂ + 2e.
D. Na⁺ + Cl⁻ → NaCl.
Câu 12. Cho độ thị khối lượng riêng của các nguyên tố kim loại chu kì 4 gồm các kim loại họ S (K, Ca) và các nguyên tố kim loại chuyển tiếp (từ Sc đến Cu): 
Dựa vào đồ thị, nhận định nào đúng trong các nhận định sau:
A. Kim loại họ S có khối lượng riêng lớn hơn kim loại chuyển tiếp.
B. Từ Scandium (Sc) đến Copper (Cu), khối lượng riêng của các nguyên tố giảm dần.
C. Kim loại họ S có khối lượng riêng nhỏ hơn kim loại chuyển tiếp.
D. Kim loại họ S có khối lượng riêng gần bằng kim loại chuyển tiếp.
Câu 13. Trong cơ thể người, ion Mg²⁺ (Z = 12) tham gia cấu trúc tế bào, tổng hợp protein và tổng hợp chất sinh năng lượng ATP. Tổng số hạt proton và electron của ion Mg²⁺ là:
A. 22.
B. 26.
C. 12.
D. 24.
Câu 14. Chất ứng với công thức cấu tạo nào sau đây là amin bậc hai?
A. CH₃-CH₂-NH₂.
B. CH₃-CH₂-N(CH₃)₂.
C. CH₃-NH-CH₂-CH₃.
D. (CH₃)₂CH-NH₂.
Câu 15. Polymer X có công thức: 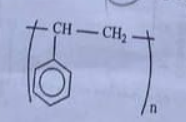
Tên của X là
A. poly(methyl methacrylate).
B. polyethylene.
C. poly(vinyl chloride).
D. polystyrene.
Câu 16. Phương pháp điện phân được sử dụng trong mạ đồng. Dưới đây là hình mô tả quá trình mạ đồng lên bề mặt chìa khóa. 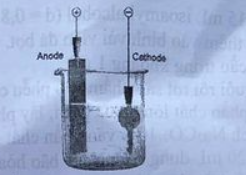
Cho các phát biểu về quá trình mạ đồng như sau:
a) Mạ đồng lên bề mặt chìa khóa nhằm trang trí bề mặt và chống sự ăn mòn kim loại.
b) Trong quá trình điện phân, thanh kim loại đồng đóng vai trò là anode, chiếc chìa khóa đóng vai trò là cathode, các điện cực cùng nhúng vào dung dịch CuSO₄.
c) Độ dày lớp mạ tỉ lệ nghịch với cường độ dòng điện chạy qua dung dịch điện phân, tỉ lệ thuận với thời gian mạ.
d) Màu xanh của dung dịch CuSO₄ không đổi (giả sử nước không bay hơi).
Số phát biểu đúng là:
A. 4.
B. 2.
C. 3.
D. 1.
Câu 17. Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng:  Cặp oxi hóa – khử | Thế điện cực chuẩn (V)Thế điện cực chuẩn lớn nhất là:
Cặp oxi hóa – khử | Thế điện cực chuẩn (V)Thế điện cực chuẩn lớn nhất là:
A. 0,459.
B. 1,102.
C. 0,78.
D. 1,102.
Câu 18. Tên gọi của ester HCOO CH₃ là:
A. methyl formate.
B. ethyl acetate.
C. ethyl formate.
D. methyl acetate.
PHẦN III. TỰ LUẬN (6 câu)
Câu 1. Thí sinh trả lời từ câu 1 đến câu 6.
(1) Thả đinh sắt vào dung dịch HCl.
(2) Thả đinh sắt vào dung dịch FeCl₃.
(3) Thả đinh sắt vào dung dịch Cu(NO₃)₂.
(4) Đốt dây sắt trong bình khí chứa đầy khí O₂.
(5) Đốt một dây nickel với một dây sắt rồi để trong không khí ẩm.
(6) Thả đinh sắt vào dung dịch chứa đồng thời CuSO₄ và H₂SO₄ loãng.
Có bao nhiêu thí nghiệm mà sắt bị ăn mòn điện hóa?
Câu 2. Cho các phát biểu sau về carbohydrate:
(1) Glucose và saccharose đều là chất rắn có vị ngọt, dễ tan trong nước.
(2) Maltose tinh bột và cellulose đều là polysaccharide.
(3) Trong dung dịch, glucose và saccharose đều kết tủa đỏ gạch với Cu(OH)₂/OH⁻ khi đun nóng.
(4) Khi α-glucose phản ứng với CH₃OH/HCl tạo sản phẩm là methyl α-glucoside.
(5) Khi đun nóng glucose (hoặc fructose) với dung dịch AgNO₃ trong NH₃ thu được Ag.
(6) Glucose, fructose và saccharose đều bị khử bởi LiAlH₄ do trong phân tử của mỗi chất có một nhóm carbonyl.
Có bao nhiêu phát biểu đúng trong các phát biểu trên?
Câu 3. Cho 7,3 gam amin bậc hai đơn chức X tác dụng với dung dịch HCl vừa đủ thu được 10,95 gam muối. Xác định công thức phân tử của amin X.
Câu 4. Ion calcium (Ca²⁺) rất cần thiết cho mọi hoạt động bình thường. Nồng độ ion calcium trong máu bình thường là dấu hiệu bệnh tật. Để xác định nồng độ ion calcium, người ta lấy mẫu máu, sau đó kết tủa ion calcium dưới dạng calcium oxalate (CaC₂O₄) rồi cho calcium oxalate tác dụng với dung dịch potassium permanganate trong môi trường acid theo phương trình sau:
5CaC₂O₄ + 2KMnO₄ + 8H₂SO₄ → 5CaSO₄ + K₂SO₄ + 2MnSO₄ + 10CO₂ + 8H₂O
Giả sử calcium oxalate kết tủa từ 1 mL mẫu máu người được chuẩn độ vừa hết với 2 mL dung dịch potassium permanganate (KMnO₄) 5.10⁻⁴ M. Xác định nồng độ ion calcium trong máu người đó bằng đơn vị mg Ca²⁺/100 mL máu.
Câu 5. Cho các polymer sau: polyethylene, poly(methyl methacrylate), poly(vinyl chloride), polyacrylonitrile. Có bao nhiêu polymer điều chế bằng phản ứng trùng hợp?
Câu 6. Hoà tan hết 2,0 gam mẫu sắt rắn có thành phần chính là muối (NH₄)₂SO₄.FeSO₄.6H₂O (muối Mohr) vào 20,0 mL dung dịch H₂SO₄ 1M, thêm nước thu được 100,0 mL dung dịch X. Để chuẩn độ vừa hết 20,0 mL dung dịch X cần dùng 5,0 mL dung dịch KMnO₄ 0,02 M (KMnO₄ chỉ phản ứng với ion Fe²⁺ trong dung dịch, sản phẩm có chứa Mn²⁺). Xác định % khối lượng (NH₄)₂SO₄.FeSO₄.6H₂O trong mẫu muối trên (làm tròn kết quả đến hàng phần mười).
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




