Đề thi thử Đại học 2025 môn Hóa học – Sở GD Nghệ An đợt 1 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, trong chương trình Đề thi vào Đại học.
Đề thi được biên soạn sát với đề minh họa 2025 của Bộ GD&ĐT, bao gồm đầy đủ các chuyên đề trọng tâm như: este – lipit, amino axit – protein, polime, kim loại, phản ứng vô cơ – hữu cơ, bài toán bảo toàn và nhận biết hóa chất. Với mức độ phân hóa tốt, đề giúp học sinh rèn luyện kỹ năng xử lý câu hỏi nhanh, chính xác và đánh giá năng lực toàn diện.
Hãy cùng Dethitracnghiem.vn bắt đầu luyện tập với đề thi này để chinh phục kỳ thi sắp tới!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GD NGHỆ AN
Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Cl = 35,5.
PHẦN I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi chỉ có 1 lựa chọn đúng nhất. (3,6 điểm)
Câu 1. Để chuyển hóa dầu mỡ động thực vật thành xà phòng hoặc muối natri của axit béo và glixerol, người ta thực hiện quá trình
A. xà phòng hóa dầu mỡ động thực vật.
B. làm lạnh dầu mỡ động thực vật.
C. oxi hóa dầu mỡ động thực vật ở nhiệt độ cao.
D. hiđro hóa dầu mỡ động thực vật.
Câu 2. Etyl axetat là este có mùi thơm đặc trưng, được sử dụng làm dung môi cho nước hoa, sơn móng tay… Công thức cấu tạo thu gọn của este này là
A. C₂H₅COOCH₃.
B. CH₃COOC₂H₅.
C. CH₃COCH₂CH₃.
D. CH₃COOCH₃.
Câu 3. Glucozơ là chất rắn có vị ngọt, dễ tan trong nước. Sacarozơ có công thức phân tử là C₁₂H₂₂O₁₁. Glucozơ và sacarozơ đều
A. C₆H₁₂O₆.
B. C₆H₁₀O₅.
C. C₅H₁₀O₅.
D. C₁₂H₂₂O₁₁.
Câu 4. Trong sản xuất nhôm bằng phương pháp điện phân nhôm oxit nóng chảy trong criolit, vật liệu dùng làm anot bị ăn mòn dần. Vật liệu đó là
A. Than chì (graphite).
B. Sắt.
C. Nhôm.
D. Titan.
Câu 5. Trong pin điện hóa, cực âm là cực (hay điện cực) xảy ra quá trình
A. khử.
B. oxi hóa.
C. điện phân.
D. trao đổi ion.
Câu 6. Trong quá trình điện phân dung dịch KCl bão hòa với điện cực trơ (graphite) thu được khí nào sau đây ở anot?
A. O₂.
B. Cl₂.
C. HCl.
D. H₂.
Câu 7. Tên hệ thống của amino acid H₂N-CH₂-COOH là
A. 2-aminoethanoic acid.
B. β-aminoacetic acid.
C. Glycine.
D. aminoethanoic acid.
Câu 8. Phức chất cis-dichloro(ethylenediamine)platinum(II) có công thức cấu tạo sau:
Số lượng phối tử có trong phức chất trên là
A. 1.
B. 2.
C. 4.
D. 8.
Câu 9. Arachidonic acid (AA) hay ARA) được ứng dụng rộng rãi, đặc biệt là trong ngành sản xuất mỹ phẩm và chăm sóc sức đẹp.
Cho các nhận định sau:
(a) Arachidonic acid có công thức phân tử là C₂₀H₃₂O₂.
(b) Arachidonic acid thuộc nhóm acid béo omega-6.
(c) Arachidonic acid là một chất béo lỏng.
(d) Một phần tử Arachidonic acid tác dụng tối đa với n mol phân tử hydrogen ở điều kiện thích hợp, số n là 4.
Các nhận định đúng là
A. (a), (b), (c).
B. (a), (b), (d).
C. (a), (c), (d).
D. (a), (b), (c), (d).
Câu 10. Nước cứng gây nhiều trở ngại cho đời sống thường ngày. Các nguồn nước ngầm hoặc nước ở các ao hồ, sông suối thường có độ cứng cao bởi quá trình hòa tan các ion Ca²⁺, Mg²⁺ có trong thành phần của lớp trầm tích đá vôi. Cho các phát biểu sau:
(a) Cơ thể dùng Na₃PO₄ để làm mềm nước có tính cứng vĩnh cửu.
(b) Nấu ăn bằng nước cứng làm thực phẩm lâu chín, giảm mùi vị.
(c) Nước tự nhiên có chứa ion Ca²⁺, Mg²⁺, Cl⁻, SO₄²⁻ gọi là nước có tính cứng tạm thời.
(d) Nước không chứa hoặc chứa ít các ion Ca²⁺ và Mg²⁺ được gọi là nước mềm.
Số phát biểu đúng là
A. 1.
B. 2.
C. 4.
D. 3.
Câu 11. Kim loại nhóm IA đều là kim loại nhẹ, có khối lượng riêng nhỏ là do
A. có bán kính nguyên tử lớn và cấu trúc mạng tinh thể kém đặc khít.
B. có độ âm điện lớn và thế điện cực chuẩn nhỏ.
C. có bán kính nguyên tử nhỏ và cấu trúc mạng tinh thể đặc khít.
D. có độ âm điện nhỏ và thế điện cực chuẩn nhỏ.
Câu 12. Dãy nào sau đây sắp xếp các kim loại Li, Na, K theo mức độ phản ứng với oxygen giảm dần?
A. Li, Na, K.
B. Na, K, Li.
C. K, Na, Li.
D. K, Li, Na.
Câu 13. Ethylene là một trong những hóa chất quan trọng, có nhiều ứng dụng trong đời sống. Phản ứng hóa học của ethylene với dung dịch Br₂ như sau:![]()
Nhận định nào sau đây không đúng?
A. Hiệu ứng trong của phản ứng là dịch bromin bị nhạt màu dần.
B. Giai đoạn 2 có sự hình thành liên kết π.
C. Giai đoạn 1 có sự phá vỡ liên kết π trong liên kết đôi C=C.
D. Phản ứng trên thuộc loại phản ứng cộng.
Câu 14. Quặng Zinc blende (chứa ZnS) là loại quặng chứa kẽm trong tự nhiên. Trong công nghiệp, để tách kim loại Zn từ quặng zinc blende tiền hành theo sơ đồ sau:
Phương pháp điều chế kim loại nào đã được sử dụng trong quá trình sản xuất Zn theo sơ đồ trên?
A. Điện phân nóng chảy.
B. Nhiệt luyện.
C. Thủy luyện.
D. Điện phân dung dịch.
Câu 15. Cho 1 số hiện tượng sau:
(a) Sáp nến chảy ra bị đông lại khi nguội.
(b) Sục khí chua vôi đục khi thổi hơi thở vào.
(c) Mắt kính đeo lâu ngày thấy có hiện tượng kết tủa.
(d) Đậu phụ được làm từ sữa đậu nành.
Số hiện tượng khẳng định sự biến đổi vật lý là
A. 4.
B. 2.
C. 3.
D. 1.
Câu 16. Trong quá trình hoạt động của pin Zn – Cu, quá trình xảy ra ở anot là
A. Cu → Cu²⁺ + 2e.
B. Zn → Zn²⁺ + 2e.
C. Zn²⁺ + 2e → Zn.
D. Cu²⁺ + 2e → Cu.
Câu 17. Trong công nghiệp, nguyên liệu thường dùng để sản xuất vôi sống, xi măng, vật liệu xây dựng là đá vôi. Thành phần chính của đá vôi là
A. CaCO₃.
B. Ca₃(PO₄)₂.
C. CaSO₄.
D. Ca(H₂PO₄)₂.
Câu 18. “Nhiệt độ tới hạn” và “áp suất tới hạn” là
A. những điều kiện mà tại đó chất lỏng và khí cùng tồn tại ở trạng thái cân bằng.
B. những điều kiện mà tại đó chất lỏng và khí không thể phân biệt được.
C. những điều kiện mà tại đó chất lỏng và khí cùng tồn tại ở trạng thái bền.
D. những điều kiện mà tại đó chất lỏng và khí chuyển pha hoàn toàn.
PHẦN II: Câu trắc nghiệm tự luận. Thí sinh trả lời từ câu 1 đến câu 4. (4,0 điểm)
Câu 1. Nhóm học sinh tìm hiểu về quá trình thu acid lactic từ đường glucose thông qua lên men lactic. Với giả thuyết “Nhiệt độ càng cao thì lượng lactic acid thu được càng nhiều”, Nhóm đã thực hiện thí nghiệm như sau:
Chuẩn bị dung dịch glucose 5%, chế phẩm vi sinh vật (vi khuẩn men lactic lactobacillus), 5 ống nghiệm có nắp, bép điện, nhiệt kế.
Cách làm: Lấy 200 mL dung dịch glucose cho vào mỗi ống nghiệm. Thêm một ít chế phẩm vi sinh vật vào mỗi ống nghiệm. Đậy nắp và ủ ở các nhiệt độ: 20°C (mẫu 1), 30°C (mẫu 2), 37°C (mẫu 3), 45°C (mẫu 4), mẫu trắng không thêm vi sinh vật (mẫu trắng).
Sau 7 ngày, lấy các mẫu đem lọc sạch, để ổn định ở nhiệt độ môi trường rồi lấy thể tích dung dịch trong các mẫu làm như bảng, mỗi lần lấy 5 mL mẫu; mẫu trắng và các mẫu 1; 2; 3; 4 rồi pha loãng thành 100 mL và tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M với chỉ thị phenolphtalein. Kết quả thu được như bảng sau:

Biết rằng trong các mẫu chỉ có chứa C₆H₁₂O₆, CH₃CH(OH)COOH (lactic acid) và H₂O.
a) Từ kết quả thí nghiệm, kết luận giả thuyết của nhóm học sinh trên là đúng hay sai? Giải thích.
b) Trong mẫu trắng đã có sẵn một lượng lactic acid đáng kể không? Giải thích.
c) Nhiệt độ tối ưu cho quá trình lên men tạo acid lactic là bao nhiêu?
d) Trong thí nghiệm trên, lượng acid lactic được tạo ra nhiều nhất trong một mẫu (200 mL) là 3,78 gam. Tính hiệu suất quá trình lên men glucose thành lactic acid trong mẫu đó.
Câu 2. Lysine và cadaverine là hai hợp chất liên quan đến quá trình phân hủy protein. Lysine là một amino acid thiết yếu còn cadaverine được hình thành từ sự khử carboxyl của Lysine dưới tác động của enzyme trong môi trường yếm khí. Về cấu tạo, phân tử lysine, thay thế nhóm carboxyl bằng nguyên tử hydrogen thì thu được phân tử cadaverine.
a) Công thức phân tử của cadaverine là C₅H₁₄N₂.
b) Lysine và cadaverine đều có hai nhóm amino trong phân tử.
c) Lysine thuộc loại amino acid, còn cadaverine không phải amino acid.
d) Ở pH = 7, cả hai chất đều tồn tại ở dạng ion lưỡng cực.
Số phát biểu đúng là
Câu 3. Một học sinh tiến hành thí nghiệm nghiên cứu sự tạo thành phức chất, phản ứng của phức chất iron(III) với ion thiocyanat.
Bước 1: Hòa tan iron(III) sulfate vào ống nghiệm chứa nước thu được dung dịch màu vàng nâu. Sau một thời gian, thấy có kết tủa màu nâu đỏ trong ống nghiệm.
Bước 2: Lọc bỏ kết tủa, thêm KSCN (potassium thiocyanat) vào nước lọc thấy dung dịch chuyển sang màu đỏ máu của phức chất sắt bớt bền ở nhiệt độ cao.
Bước 3: Thêm dung dịch KF dư vào ống nghiệm thấy dung dịch nhạt màu dần và mất màu do tạo phức chất [FeF₆]³⁻.
a) Các phức chất được tạo thành ở bước 2, 3 là phức chất trong tính, không mang điện tích.
b) Ở bước 1 đã xảy ra quá trình hình thành và thủy phân phức chất aquo của ion Fe³⁺.
c) Trong thí nghiệm trên, khi tạo phức với ion Fe³⁺, phối tử là anion tạo ra phức chất có màu đậm hơn phối tử là phân tử trung hòa.
d) Ở bước 2, xảy ra phản ứng thay thế phối tử H₂O bằng phối tử SCN⁻.
Số nhận định đúng là
Câu 4. Một nhóm học sinh nghiên cứu sự ăn mòn kim loại của một sợi kẽm với giả thuyết: “Trong cùng điều kiện, tốc độ ăn mòn kim loại nhanh hơn tốc độ ăn mòn hóa học”. Để kiểm tra giả thuyết của mình, nhóm học sinh trên đã chuẩn bị 2 sợi kẽm có kích thước, khối lượng như nhau và tiến hành các thí nghiệm như sau:
Thí nghiệm 1: Nhúng một sợi kẽm vào dung dịch H₂SO₄ 0,5M (hình 1).
Thí nghiệm 2: Nhúng sợi kẽm còn lại vào dung dịch H₂SO₄ 0,5M cùng với một sợi đồng và nối chúng lại qua vòng dẫn (hình 2).
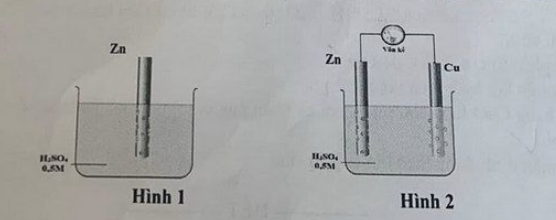
a) Nhóm học sinh trên quan sát thấy bọt khí thoát ra trên bề mặt sợi kẽm ở thí nghiệm 1 nhanh hơn bọt khí thoát ra trên bề mặt sợi kẽm ở thí nghiệm 2, chứng tỏ giả thuyết trên là sai.
b) Nếu thế điện cực chuẩn thì vôn kế luôn chỉ giá trị dương là 1,10 V.
c) Ở thí nghiệm 2, quan sát thấy bọt khí thoát ra trên bề mặt sợi đồng, chứng tỏ sợi đồng bị ăn mòn điện hóa học.
d) Sau 3 phút, nhóm học sinh lấy 2 sợi kẽm ra cân lại, thấy khối lượng sợi kẽm ở thí nghiệm 1 lớn hơn khối lượng sợi kẽm ở thí nghiệm 2, chứng tỏ giả thuyết trên là đúng.
Số nhận định đúng là
PHẦN III: Câu trắc nghiệm tự luận trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6. (2,4 điểm)
Câu 1. DEP (diethyl phthalate) được dùng làm thuốc điều trị bệnh ghẻ và giảm triệu chứng sưng tấy ở vùng da bị côn trùng cắn. Có thể điều chế DEP từ o-xylene qua 2 giai đoạn như sau:
(hình ảnh sơ đồ phản ứng điều chế DEP)
Một loại thuốc DEP thành phần thiêm (trọng lượng 10 g) có lượng diethyl phthalate là 96% (về khối lượng). Lấy tinh số lượng o-xylene cần dùng để sản xuất lượng DEP đó biết hiệu suất quá trình toàn trình là 72%. (Làm tròn đến hàng đơn vị).
Câu 2. Trong công nghiệp, sản xuất nước Javel được thực hiện bằng phương pháp điện phân dung dịch NaCl bão hòa không có màng ngăn giữa anot và catot:

Cl₂(g) + 2NaOH(aq) → NaCl(aq) + NaClO(aq) + H₂O(l)
Một loại nước Javel (có khối lượng riêng 1,15 g/cm³) được bán trên thị trường với nồng độ NaCl, NaClO và NaOH lần lượt là 10%, 8% và 0,8% (theo khối lượng). Để sản xuất 500 can nước Javel, cần bao nhiêu kg dung dịch NaCl 18,5% (theo khối lượng) để làm nguyên liệu ban đầu?
Câu 3. Cho các thế điện cực chuẩn của các cặp oxi hóa – khử như bảng sau:
![]()
Dựa vào bảng trên, xác định những phản ứng nào xảy ra được ở điều kiện tiêu chuẩn khi cho Ag vào dung dịch chứa đồng(II) sulfat. Viết phương trình hóa học của phản ứng xảy ra (nếu có).
Câu 4. Một nhà máy nhiệt điện khi sử dụng lượng điện 10⁶ kWh (1 kWh = 3600 J) sử dụng than đá làm nhiên liệu, hiệu suất là 40%. Lượng nhiệt tỏa ra khi đốt cháy hoàn toàn 1 kg than đá là 29.10⁶ J. Lượng LNG (Liquefied Natural Gas) được dùng làm nhiên liệu là hỗn hợp khí thiên nhiên chứa 95% CH₄, 4% C₂H₆ và 1% C₃H₈ về thể tích. Năng lượng tỏa ra khi đốt cháy hoàn toàn 1 mol các khí CH₄, C₂H₆ và C₃H₈ lần lượt là 890 kJ, 1560 kJ và 2220 kJ. Nếu nhà máy chuyển sang sử dụng LNG thay thế cho than đá, với hiệu suất vẫn là 40%, cần dùng bao nhiêu kg LNG để sản xuất cùng lượng điện năng?
Câu 5. Đốt cháy hoàn toàn một hydrocarbon X bằng khí oxygen dư, sản phẩm thu được gồm khí CO₂ và hơi nước có tỉ lệ thể tích là 10:13. Tỉ khối của X so với khí nitrogen là 1,036. Xác định công thức phân tử của X.
Câu 6. Cho 5,8 gam một hợp chất hữu cơ Y đơn chức, mạch hở tác dụng với lượng dư dung dịch AgNO₃ trong NH₃ thu được 21,6 gam kết tủa Ag. Xác định công thức cấu tạo thu gọn của Y.
Câu 7. Hợp chất hữu cơ X có công thức phân tử C₃H₆O₂. X có thể tham gia phản ứng tráng bạc và phản ứng với dung dịch NaOH. Xác định công thức cấu tạo thu gọn của X.
Câu 8. Hợp chất hữu cơ X có công thức phân tử C₄H₁₀O. Khi oxi hóa X bằng CuO nung nóng, thu được anđehit Y. Y tham gia phản ứng tráng bạc. Khi cho X tác dụng với Na dư thu được khí H₂ với số mol bằng số mol X đã phản ứng. Xác định công thức cấu tạo thu gọn của X và Y.
Câu 9. Một anđehit X có công thức đơn giản nhất là CHO. X tác dụng với dung dịch AgNO₃ trong NH₃ theo tỉ lệ mol 1:4. Xác định công thức cấu tạo thu gọn của X.
Câu 10. Cho 0,1 mol một axit cacboxylic đơn chức Z tác dụng với dung dịch NaOH vừa đủ, sau phản ứng thu được 8,2 gam muối. Xác định công thức cấu tạo thu gọn của Z.
Câu 11. Đốt cháy hoàn toàn 1,1 gam hỗn hợp X gồm metylamin và etylamin bằng lượng khí oxygen vừa đủ. Dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch NaOH dư, thu được 15,9 gam muối natri cacbonat và 5,4 gam nước. Xác định phần trăm khối lượng của metylamin trong hỗn hợp X.
Câu 12. Hỗn hợp X gồm 2 este đơn chức, đồng đẳng kế tiếp. Đốt cháy hoàn toàn 0,1 mol X cần 0,45 mol O₂, thu được CO₂ và H₂O. Cho 0,1 mol X tác dụng với dung dịch NaOH vừa đủ thu được hỗn hợp Y gồm 2 ancol Z và T. Dẫn toàn bộ Y qua bình đựng Na dư thấy khối lượng bình tăng 4,6 gam. Xác định công thức cấu tạo của 2 este trong X.
Câu 13. Cho dãy chuyển hóa sau:
![]()
Biết X, Y là các hợp chất hữu cơ. Xác định công thức cấu tạo thu gọn của Y.
Câu 14. Cho các nhận định sau:
(a) Glucozơ và fructozơ là đồng phân cấu tạo của nhau.
(b) Glucozơ và fructozơ đều bị khử bởi H₂O.
(c) Glucozơ và fructozơ đều có nhóm –OH trong phân tử.
(d) Trong môi trường kiềm, fructozơ chuyển hóa thành glucozơ.
(e) Fructozơ không có phản ứng tráng bạc.
Số nhận định đúng là
Câu 15. Cho sơ đồ chuyển hóa sau:
(hình ảnh sơ đồ chuyển hóa)
Xác định chất hữu cơ Y.
Câu 16. Sắp xếp các chất sau theo chiều nhiệt độ sôi tăng dần: CH₃COOH, CH₃CHO, C₂H₅OH, C₂H₆.
Câu 17. Sắp xếp các nhận định đúng theo thứ tự tăng dần. (Đây có thể là câu hỏi liên quan đến việc sắp xếp các nhận định từ một câu hỏi khác, hoặc là một chỉ thị cuối cùng. Tôi chép lại đúng như trong ảnh.)
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




