Đề thi thử Đại học 2025 môn Hóa học – Sở GD Quảng Bình là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi được thiết kế theo chuẩn cấu trúc đề minh họa 2025, bao gồm các chuyên đề trọng tâm như: este – lipit, amino axit – protein, polime, kim loại, bài toán bảo toàn và tổng hợp phản ứng hóa học. Nội dung câu hỏi đa dạng, phân hóa rõ rệt, giúp học sinh luyện tập kỹ năng giải nhanh, chính xác và nâng cao tư duy xử lý đề.
Hãy cùng Dethitracnghiem.vn tìm hiểu và làm thử ngay để đánh giá năng lực của bạn!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GD QUẢNG BÌNH




*Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; P = 31; S = 32; Cl = 35,5; K = 39; Ca = 40; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137;
PHẦN I. Trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Hợp chất CH3NH2 có tên thay thế là
A. ethylamine.
B. methyl amine.
C. ethanamine.
D. N-methylmethanamine.
Câu 2: Chất nào sau đây thuộc loại polysaccharide?
A. Maltose.
B. Glucose.
C. Fructose.
D. Amylose.
Câu 3: Ion kim loại.
A. Ion kim loại.
B. Nguyên tử kim loại.
C. Electron.
D. Anion. (-).
Câu 4: Quá trình sản xuất soda bằng phương pháp Solvay không sử dụng nguyên liệu nào sau đây?
A. Carbon dioxide.
B. Sodium hydroxide.
C. Muối ăn.
D. Ammonia.
Câu 5: Ion Ca2+ (Z = 20) đóng vai trò thiết yếu trong việc phát triển xương, giúp duy trì hoạt động của cơ bắp, kích thích máu lưu thông, điều tiết một số loại hormone,… Tổng số proton và electron trong một ion Ca2+ là
A. 40.
B. 42.
C. 18.
D. 38.
Câu 6: Trong thực tế, sử dụng cách nào sau đây để bảo vệ kim loại sắt khỏi bị ăn mòn?
A. Ghép nối với kim loại sắt.
B. Ngâm sắt trong dung dịch acid.
C. Phủ một lớp sơn lên bề mặt sắt.
D. Để sắt trong không khí ẩm.
Câu 7: Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố potassium cho cây trồng do chứa muối potassium carbonate. Công thức của potassium carbonate là
A. KCl.
B. KOH.
C. K2CO3.
D. KHCO3.
Câu 8: Kết quả phân tích phổ khối lượng (MS) cho thấy phân tử khối của hợp chất hữu cơ X là 59. Chất X có thể là
A. Acetic acid.
B. Acetone.
C. Vinyl formate.
D. Trimethylamine.
Câu 9: Phản ứng nào sau đây được gọi là phản ứng ester hóa?
A. Thủy phân ester trong môi trường kiềm.
B. Thủy phân ester trong môi trường acid.
C. Phản ứng hydrogen hóa chất béo chưa gốc acid không no.
D. Phản ứng điều chế ester từ carboxylic acid và alcohol.
Câu 10: Polypropylene có công thức là
A. -(CH2 -CHCl)-n.
B. -(CH2 -CCl-CH=CH)-n.
C. -(CH2 -CH(CH3))-n.
D. -(CH2-CH-CH2-CH)-n.
Câu 11: Theo quy định, tất cả các loại chất lỏng, tinh dầu được coi là chất lỏng dễ cháy và là hàng hoá nguy hiểm nếu có điểm chớp cháy nhỏ hơn 60°C hoặc không được vận chuyển qua đường hàng không.
Cho điểm chớp cháy của một số loại tinh dầu thường gặp như sau:
 Trong các tinh dầu trên, theo quy định có bao nhiêu tinh dầu hành khách không được phép mang theo lên máy bay?
Trong các tinh dầu trên, theo quy định có bao nhiêu tinh dầu hành khách không được phép mang theo lên máy bay?
A. 6.
B. 4.
C. 5.
D. 2.
Câu 12: Phản đạm cung cấp nguyên tố nitrogen cho cây trồng ở dạng ammonium NH4+, nitrate NO3-. Độ dinh dưỡng của phân đạm được tính bằng phần trăm khối lượng của nguyên tố nitrogen có trong loại phân bón đó. Loại phân đạm nào sau đây có độ dinh dưỡng thấp nhất?
A. NH4Cl.
B. CO(NH2)2.
C. NH4NO3.
D. (NH4)2SO4.
Câu 13: Công thức cấu tạo thu gọn của ethyl ethanoate là
A. HCOO CH2CH3.
B. CH3COOH.
C. CH3COOCH2CH3.
D. C2H5COOCH2CH3.
Câu 14: Phản ứng hóa học của phản ứng nitro hóa benzene để tạo thành nitrobenzene là

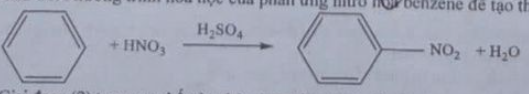 Nhận định nào sau đây không đúng?
Nhận định nào sau đây không đúng?
A. Phản ứng nitro hóa benzene là phản ứng thế.
B. Trong giai đoạn (2) ở trên có sự hình thành liên kết ở.
C. Sản phẩm phản ứng có 12 nguyên tử H.
D. X có công thức phân tử của nitrobenzene.
Câu 15: Cho phản ứng hoá học: Cu + 2Fe3+ -> Cu2+ + 2Fe2+.
Phát biểu nào sau đây về phản ứng trên không đúng?
A. Cu bị Fe3+ oxi hoá thành Cu2+.
B. Cu2+ có tính oxi hoá mạnh hơn Fe3+.
C. Fe3+ bị Cu khử thành Fe2+.
D. Cu là chất khử, Fe+ là chất oxi hoá.
Câu 16: Pin điện hóa có thể ký hiệu đơn giản: kim loại 1 (anode) | dung dịch muối | kim loại 2 (cathode). Cho sức điện động chuẩn của các pin điện hóa sau: E°Zn(Cu-Zn) = 0,46 V; E°Zn(Cu-Z) = 2,71 V; E°Zn(Z-Cu) = 0,78 V (với X, Y, Z là ba kim loại). Dãy sắp xếp các kim loại X, Y, Z theo chiều tăng dần tính khử là
A. X, Y, Z.
B. X, Z, Y.
C. Z, Y, X.
D. Y, Z, X.
Câu 17: “Peptide là những hợp chất hữu cơ được cấu tạo bởi các đơn vị… (1) … liên kết với nhau qua liên kết … (2) …”. Nội dung phù hợp trong ô trống (1), (2) lần lượt là
A. α-amino acid, peptide (-CO-NH-).
B. β-amino acid, amide (-CO-NH-).
C. α-amino acid, amide (-CO-NH-).
D. β-amino acid, peptide (-CO-NH-).
Câu 18: Glutamic acid là một trong những amino acid thiết yếu đối với cơ thể con người. Với mỗi môi trường có giá trị pH bằng 1,0; 3,2; 12,0, ion glutamic acid tồn tại ở dạng cho dưới đây:
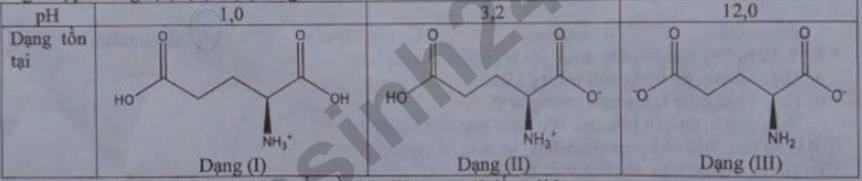 Trong các nhận định dưới đây, ion sẽ di chuyển về phía điện cực trái (dấu âm) với dung dịch điện di:
Trong các nhận định dưới đây, ion sẽ di chuyển về phía điện cực trái (dấu âm) với dung dịch điện di:
A. Với mọi trường pH = 4,0 thì dạng (I) di chuyển về cực âm.
B. Với mọi trường pH = 3,2 thì dạng (II) hầu như không dịch chuyển về các điện cực.
C. Với mọi trường pH = 12,0 thì dạng (III) di chuyển về cực âm.
D. Với mọi trường pH = 1,0 thì dạng (I) hầu như không dịch chuyển về các điện cực.
Các nhận định đúng là
A. (a), (b).
B. (b), (c).
C. (a), (b).
D. (c), (d).
PHẦN II. Trắc nghiệm tự chấm điểm. Thí sinh chỉ trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1: Aspirin “Aspirin 81” là một loại thuốc chống đột quỵ, trong mỗi viên có chứa 81 mg aspirin. Aspirin được tổng hợp bằng cách đun hỗn hợp salicylic acid và anhydride acetic khi có mặt xúc tác sulfuric acid đặc theo phương trình hóa học sau:
(Phương trình phản ứng tổng hợp aspirin)
Hòa hỗn hợp sản phẩm thu được, làm lạnh để tạo tinh thể aspirin. Sau đó tiến hành lọc, rửa, làm khô sản phẩm.
a) Phản ứng tổng hợp aspirin là phản ứng ester hóa.
b) Sử dụng phương pháp chiết để tách aspirin ra khỏi hỗn hợp sau phản ứng.
c) 1 mol aspirin tác dụng tối đa với 3 mol NaOH trong dung dịch.
d) Để tổng hợp aspirin đủ sản xuất 1 triệu viên “Aspirin 81” cần dùng ít nhất 621 gam salicylic acid.
Câu 2: Al2O3 có nhiệt độ nóng chảy rất cao (2050°C) nên việc điện phân nóng chảy Al2O3 nguyên chất sẽ khó thực hiện. Hiện nay, theo công nghệ Hall – Héroult, người ta hòa tan Al2O3 trong cryolite (Na3AlF6) nóng chảy, được hỗn hợp chất điện phân có nhiệt độ nóng chảy thấp hơn (khoảng gần 1000°C). Giải pháp này giúp tiết kiệm năng lượng, đồng thời tạo ra chất lỏng có tính dẫn điện tốt, nhẹ hơn Al và nổi lên phần trên lớp Al lỏng, bảo vệ Al không bị oxi hoá bởi không khí. Sơ đồ thùng điện phân được biểu diễn như hình dưới:
(Hình vẽ thùng điện phân)
Quá trình điện phân được tiến hành với dòng điện có hiệu điện thế thấp (U = 5 V) và cường độ dòng điện 100-300 kA.
Cho biết: Năng lượng điện tiêu thụ theo lí thuyết: A = (U.m.F) / (9×3,6.10⁶) (kWh), trong đó mAl là khối lượng Al được điều chế (gam); F là hằng số Faraday (F = 96485 C mol-1); U (V) là hiệu điện thế áp đặt vào hai cực của bình điện phân.
a) Cryolite không bị điện phân trong thùng điện phân.
b) Tại anode xảy ra quá trình oxi hoá Al3+.
c) Năng lượng điện tiêu thụ để sản xuất được 1 kg Al theo lí thuyết là 14 kWh (đã làm tròn đến hàng đơn vị).
d) Bên cạnh nhôm, oxygen tinh khiết cũng thu được trực tiếp từ quy trình này.
Câu 3: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vào 3 ống nghiệm, mỗi ống 5 mL dung dịch H2SO4 0,5 M (loãng).
Bước 2: Lần lượt cho các miếng kim loại Al, Fe, Zn có kích thước như nhau và đã làm sạch bề mặt vào các ống nghiệm được đánh số tương ứng (1), (2), (3).
Biết: E°Al3+/Al = -1,676 V, E°Fe2+/Fe = -0,440 V, E°Zn2+/Zn = -0,762 V.
a) Tốc độ khí thoát ra ở ống nghiệm (2) nhanh hơn ở ống nghiệm (1).
b) Ở bước 2, cả ba ống nghiệm đều có khí thoát ra.
c) Ở bước 2, nếu thêm tiếp 5 mL dung dịch H2SO4 1 M (loãng) vào cả 3 ống nghiệm thì tốc độ thoát khí ở cả ba ống nghiệm sẽ tăng lên.
d) Ở bước 1, nếu thay dung dịch H2SO4 0,5 M bằng dung dịch H2SO4 98% (đặc) thì sau bước 2, hiện tượng xảy ra ở các ống nghiệm giống như dùng dung dịch H2SO4 0,5 M.
Câu 4: Enzyme amylase (là một protein) có khả năng xúc tác cho phản ứng thủy phân tinh bột. Hoạt tính xúc tác của enzyme càng cao thì phản ứng thủy phân tinh bột diễn ra càng nhanh. Hoạt tính xúc tác của enzyme phụ thuộc vào các yếu tố như nhiệt độ, pH,… Một nhóm học sinh đưa ra giả thuyết “nhiệt độ càng tăng thì tốc độ phản ứng thủy phân tinh bột nhờ xúc tác enzyme amylase xảy ra càng nhanh”. Từ đó, học sinh tiến hành thí nghiệm ở pH khoảng đó (pH=7) tại các nhiệt độ 20°C; 30°C; 40°C; 50°C; 60°C; 70°C để kiểm tra dự đoán trên như sau:
(Đồ thị biểu diễn thời gian thủy phân tại các nhiệt độ khác nhau)
Bước 1: Thêm 2 mL dung dịch một loại enzyme amylase vào một ống nghiệm chứa dung dịch có vai trò duy trì pH = 7,0 (dung dịch đệm).
Bước 2: Thêm tiếp 2 mL dung dịch tinh bột vào ống nghiệm trên, lắc đều.
Bước 3: Sau khoảng mỗi 10 giây, dùng ống hút lấy 1-2 giọt hỗn hợp phản ứng trong ống nghiệm và cho vào đĩa sứ chứa sẵn dung dịch iodine (màu vàng), quan sát sự thay đổi màu sắc. Tiếp tục thử cho đến khi hỗn hợp phản ứng không còn làm mất màu của dung dịch iodine. Ghi lại thời điểm đó và độ dài thời gian phản ứng tại các nhiệt độ: 20°C; 30°C; 40°C; 50°C; 60°C; 70°C.
a) Sự thay đổi màu sắc của dung dịch iodine chuyển sang màu xanh tím nghĩa là tinh bột chưa bị thủy phân hết.
b) Theo số liệu phản ứng, phản ứng thủy phân tinh bột ở 40°C diễn ra nhanh hơn ở 50°C.
c) Ở nhiệt độ bằng nhiệt độ cơ thể (37°C), tốc độ phản ứng thủy phân tinh bột nhờ xúc tác enzyme amylase xảy ra nhanh nhất.
d) Giả thuyết thí nghiệm chứng minh giả thuyết nghiên cứu ở trên của nhóm học sinh trong khoảng từ 20°C đến 70°C là sai.
PHẦN III. Trắc nghiệm tự luận. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: Khi sử dụng xà phòng trong nước cứng, sẽ có phản ứng tạo thành kết tủa chứa calcium oleate ((C17H33COO)2Ca). Phân tử khối của calcium oleate là bao nhiêu?
(Handwritten: 602)
Câu 2: Thủy phân một tripeptide X (mạch hở) thu được hỗn hợp glycine, alanine (có tỉ lệ số mol 2:1). Có bao nhiêu đồng phân cấu tạo của X thỏa mãn tính chất trên?
(Handwritten: 3)
Câu 3: Một nhà máy luyện kim, ở giai đoạn đầu của quá trình sản xuất Zn từ quặng kẽm blend được sản phẩm phụ là SO2 theo sơ đồ phản ứng: ZnS + O2 -> ZnO + SO2.
Đốt cháy 1 tấn quặng kẽm blend (chứa 77,6% khối lượng ZnS) bằng không khí, thu được tối đa V m³ khí SO2 (đkc). Tính giá trị của V (làm tròn đến hàng đơn vị).
(Handwritten: 198)
Câu 4: Trong quá trình bảo quản, một mẫu muối FeSO4.7H2O bị oxi hóa bởi oxygen trong không khí tạo thành hỗn hợp X chứa các hợp chất của Fe(II) và Fe(III). Hòa tan hoàn toàn X trong dung dịch loãng chứa 0,05 mol H2SO4, thu được 100 mL dung dịch Y. Tiến hành hai thí nghiệm với dung dịch Y:
Thí nghiệm 1: Cho lượng dư dung dịch BaCl2 vào 25,0 mL dung dịch Y, thu được 6,99 gam kết tủa.
Thí nghiệm 2: Lấy 25,0 mL dung dịch Y cho từ từ vào dung dịch KMnO4 0,1 M vào dung dịch Y đến khi dung dịch Y mất màu tím hoàn toàn thì dừng lại. Thể tích dung dịch KMnO4 0,1 M đã dùng là 30,0 mL. Tính phần trăm số mol Fe(II) đã bị oxi hóa trong không khí (làm tròn đến hàng phần mười).
(Handwritten: 14.3)
Câu 5: Tiến hành ghi phổ hồng ngoại (IR) một hợp chất có công thức phân tử C3H8O2 thu được kết quả như sau:
(Hình vẽ phổ IR)
Số sóng hấp thụ đặc trưng trên phổ hồng ngoại của một số liên kết như sau:
(Bảng số sóng các liên kết)
Gán số thứ tự tương ứng với liên kết cho để gán trên lần lượt theo các đỉnh hiệu (peak): (X), (Y), (Z) ở phổ hồng ngoại trên thành dãy 3 số: (Ví dụ: 123; 543; 512;…).
Câu 6: Trong ứng nhiệt nhôm một hỗn hợp nhiệt nhôm có thể làm nóng chảy kim loại sinh ra sau phản ứng. Người ta đung nóng hỗn hợp gồm Al và Fe3O4 (hỗn hợp thermite) để hàn đường ray tàu hỏa, phản ứng sinh ra sắt ở dạng nóng chảy nên lượng sắt này dùng để hàn gắn đường ray và Al2O3 sinh ra nổi lên trên bảo vệ bề mặt trong lúc hàn, hạn chế sự oxi hóa sắt.
Cho biết ΔrH°298(Al2O3(s)) = -1675,7 kJ/mol; ΔrH°298(Fe3O4(s)) = -1121,0 kJ/mol.
Khi cho 45,6 gam hỗn hợp Al và Fe3O4 (có tỉ lệ số mol tương ứng 8:3) phản ứng hoàn toàn thì lượng nhiệt tỏa ra bằng bao nhiêu kJ? (làm tròn đến hàng đơn vị).
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




