Đề thi thử Đại học 2025 môn Hóa học – Sở GDĐT Ninh Bình (Lần 2) là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, nằm trong chương trình Đề thi vào Đại học.
Đề thi được xây dựng bám sát cấu trúc đề minh họa 2025 của Bộ GD&ĐT, bao phủ các chuyên đề trọng tâm như: Este – Lipit, Amin – Amino axit, Cacbohiđrat, Kim loại, Phi kim và Hóa học đại cương. Với độ phân hóa rõ ràng và cách ra đề logic, đây là tài liệu hữu ích giúp học sinh luyện tập kỹ năng làm bài nhanh và chính xác.
Cùng Dethitracnghiem.vn thử sức với đề thi này để sẵn sàng bứt phá trong kỳ thi THPT Quốc gia 2025!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GDĐT NINH BÌNH (LẦN 2)
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Insulin là hoocmon của cơ thể có tác dụng điều tiết lượng đường trong máu. Thủy phân một phần insulin thu được heptapeptide (X). Khi thủy phân không hoàn toàn X thu được hỗn hợp các peptide trong đó có các peptide sau: Ser-His-Leu; Val-Glu-Ala; His-Leu-Val; Gly-Ser-His. Nếu đánh số amino acid đầu N trong X là số 1 thì amino acid Val sẽ ở vị trí số :
A. 3.
B. 5.
C. 2.
D. 4.
Câu 2: Kí hiệu cặp oxi hoá – khử ứng với quá trình khử: Fe³⁺ + 1e⁻ → Fe²⁺ là :
A. Fe²⁺/Fe.
B. Fe³⁺/Fe.
C. Fe³⁺/Fe²⁺.
D. Fe²⁺/Fe³⁺.
Câu 3: Điện phân dung dịch AgNO₃ với anode và cathode trơ. Quá trình xảy ra ở cathode tại giai đoạn đầu của phản ứng điện phân là :
A. 2H₂O(l) → O₂(g) + 4H⁺(aq) + 4e⁻.
B. 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻ (aq).
C. Ag⁺(aq) + e⁻ → Ag(s).
D. Ag(s) → Ag⁺(aq) + e⁻.
Câu 4: Số đồng phân alkene có công thức phân tử C₄H₈ là :
A. 4.
B. 3.
C. 6.
D. 5.
Câu 5: Trong số các ion: Ag⁺, Al³⁺, Fe²⁺, Cu²⁺, ion nào có tính oxi hoá mạnh nhất ở điều kiện chuẩn ?
A. Ag⁺.
B. Fe²⁺.
C. Cu²⁺.
D. Al³⁺.
Câu 6: Ester nào sau đây khi thủy phân trong môi trường kiềm cho muối acetate ?
A. C₂H₅COOCH₃.
B. HCOOC₂H₅.
C. HCOOCH₃.
D. CH₃COOCH₃.
Câu 7: Tinh bột và cellulose là các polymer tự nhiên tạo bởi các mắt xích tương ứng là :
A. α-fructose và β-glucose.
B. β-fructose và β-glucose.
C. α-glucose và β-fructose.
D. α-glucose và β-glucose.
Câu 8: Trong công nghiệp, nhôm được sản xuất từ quặng bauxite theo 2 giai đoạn chính :
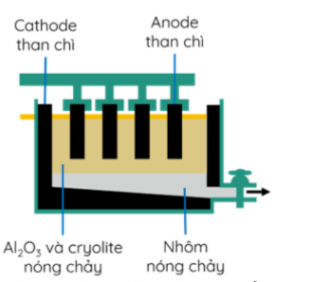
Giai đoạn 1: Tinh chế quặng bauxite.
Giai đoạn 2: Điện phân Al₂O₃ nóng chảy (Al₂O₃ được trộn cùng với cryolite Na₃AlF₆).
Sản phẩm điện phân ở cathode là nhôm (lỏng) và ở anode là hỗn hợp khí CO₂, CO. Cấu tạo bể điện phân như hình sau :
Sau một thời gian điện phân thu được 5,4 tấn Al tại cathode và hỗn hợp khí tại anode gồm CO₂ (chiếm 80% theo thể tích) và CO (chiếm 20% theo thể tích). Giả thiết không có thêm sản phẩm nào được sinh ra trong quá trình điện phân. Khi đó khối lượng carbon bị oxi hóa trên anode là bao nhiêu tấn?
A. 3,1.
B. 2,0.
C. 0,8.
D. 1,6.
Câu 9: Công thức phân tử của glucose là :
A. C₆H₁₂O₆.
B. C₁₂H₂₂O₆.
C. C₆H₁₂O₆.
D. C₆H₁₀O₅.
Câu 10: Tên viết tắt của peptide: HOOC-CH₂-NH-CO-CH(CH₃)NH₂ là :
A. Ala-Val.
B. Gly-Ala.
C. Ala-Gly.
D. Val-Ala.
Câu 11: X là kim loại có tính cứng lớn nhất trong các kim loại nên được mạ bên ngoài các sản phẩm để bảo vệ sản phẩm và hạn chế sự mài mòn 
X là kim loại nào sau đây?
A. W.
B. Cr.
C. Os.
D. Cs.
Câu 12: Những polymer nào sau đây thuộc loại polymer thiên nhiên?
A. Tơ tằm, tinh bột và cellulose.
B. Tơ capron, tinh bột, cellulose.
C. Tơ capron, polystyrene, tinh bột và cellulose.
D. Tơ capron, polystyrene.
Câu 13: Phản ứng của ethylene với HBr tuân theo cơ chế
A. thế electrophile.
B. cộng electrophile.
C. cộng nucleophile.
D. thế nucleophile.
Câu 14: Cho hợp chất thơm m-HO-C₆H₄-CH₂OH tác dụng với dung dịch NaOH dư. Sản phẩm hữu cơ tạo ra là
A. m-HO-C₆H₄-CH₂ONa.
B. m-NaO-C₆H₄-CH₂OH.
C. m-NaO-C₆H₄-CH₂ONa.
D. p-NaO-C₆H₄-CH₂OH.
Câu 15: Khi thay thế một nguyên tử hydrogen trong ammonia bằng một gốc hydrocarbon ta thu được hợp chất amine bậc mấy?
A. 2.
B. 4.
C. 1.
D. 3.
Câu 16: Cho biết số thứ tự của Mg trong bảng tuần hoàn là 12. Vị trí của Mg trong bảng tuần hoàn là
A. chu kì 3, nhóm IIA.
B. chu kì 2, nhóm IIB.
C. chu kì 3, nhóm IIIA.
D. chu kì 3, nhóm IIIB.
Câu 17: Quá trình đốt cháy ethanol diễn ra theo phản ứng: C₂H₅OH(l) + 3O₂(g) → 2CO₂(g) + 3H₂O(l)
Cho các giá trị năng lượng liên kết sau: E_C-C = 347 kJ/mol; E_O-O = 496 kJ/mol; E_C-O = 336 kJ/mol; E_C-H = 410 kJ/mol; E_C=O = 805 kJ/mol; E_O-H = 465 kJ/mol. Giá trị ΔrH°₂₉₈ của phản ứng trên là
A. -1324 kJ.
B. 1324 kJ.
C. -1671 kJ.
D. 1671 kJ.
Câu 18: Trong định nghĩa về liên kết kim loại: “Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron hóa trị. (1). với các ion. (2). kim loại ở các nút mạng”.
Các từ cần điền vào vị trí (1), (2) lần lượt là
A. hoá trị, âm.
B. ngoài cùng, dương.
C. tự do, dương.
D. hoá trị, lưỡng cực.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Câu 19: Trên thế giới, zinc (kẽm) được sản xuất chủ yếu từ quặng zinc blende có thành phần chính là ZnS. Một nhà máy luyện kim sản xuất Zn từ 60 tấn quặng zinc blend (chứa 80% ZnS về khối lượng, còn lại là tạp chất không chứa kẽm) với hiệu suất cả quá trình đạt 90% theo các giai đoạn:
Đốt quặng zinc blende: 2ZnS(s) + 3O₂(g) → 2ZnO(s) + 2SO₂(g) (1)
Khử zinc oxide ở nhiệt độ cao bằng than cốc: ZnO(s) + C(s) → Zn(g) + CO(g) (2)
Toàn bộ lượng kẽm tạo ra được đúc thành k thanh kẽm hình hộp chữ nhật: chiều dài 120 cm, chiều rộng 25 cm và chiều cao 15 cm. Biết khối lượng riêng của kẽm là 7,14 g/cm³.
a) Trong phản ứng (2), kẽm sinh ra ở thể rắn.
b) Theo sơ đồ trên, quặng sphalerite được nghiền, tuyển,… sau đó được chuyển hoá thành zinc oxide, cuối cùng tách được kim loại kẽm bằng phương pháp thuỷ luyện.
c) Trong phản ứng (1), chất khử là ZnS và chất oxi hóa là O₂.
d) Giá trị k bằng 90 (kết quả làm tròn đến hàng đơn vị).
Câu 20: Phân tích nguyên tố hợp chất hữu cơ E cho kết quả phần trăm khối lượng carbon, hydrogen và oxygen lần lượt là 48,65%; 8,11% và 43,24%. Dựa vào phương pháp phân tích khối phổ (MS) xác định được phân tử khối của E là 74. Mặt khác, phổ hồng ngoại (IR) cho thấy phân tử E không chứa nhóm -OH (peak có số sóng > 3000 cm⁻¹) nhưng lại chứa nhóm C=O (peak có số sóng 1748 cm⁻¹). Thuỷ phân hoàn toàn E trong dung dịch NaOH, thu được muối của carboxylic acid X và chất Y. Chất Y có nhiệt độ sôi (64,7°C) nhỏ hơn nhiệt độ sôi của ethanol (78,3°C) (nhiệt độ sôi đều đo ở áp suất 1 bar).
a) Nhiệt độ sôi của E, X và Y được xếp theo thứ tự như sau: X > E > Y.
b) Trong công nghiệp, chất Y được phối trộn với xăng RON 92 để tạo ra xăng sinh học.
c) Dung dịch muối tạo bởi giữa carboxylic acid X và NaOH có môi trường base.
d) Chất E có thể được điều chế trực tiếp từ phản ứng ester hoá giữa chất Y với ethanoic acid.
Câu 21: Cho X, Y, Z, M là các chất khác nhau trong số 4 chất sau: phenol, glycine, aniline, glutamic acid và thông tin về các chất được ghi trong bảng sau:
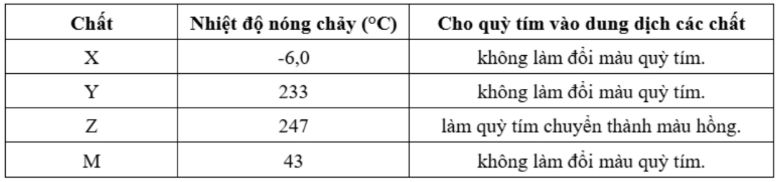
a) Thuỷ phân hoàn toàn 1,0 mol peptide A trong dung dịch NaOH thu được 3,0 mol muối của chất Y và 2,0 mol muối của chất Z thì lượng NaOH phản ứng tối đa là 7,0 mol.
b) Từ phản ứng trùng ngưng của M với formaldehyde có acid làm xúc tác có thể điều chế nhựa poly(phenol formaldehyde).
c) Cho Z tác dụng với NaOH tỉ lệ mol 1 : 1, thu được chất hữu cơ T. Khi đặt trong điện trường, chất T di chuyển về cực dương.
d) Các chất X, Y, Z, M là chất rắn ở điều kiện thường.
Câu 22: Công đoạn chính của công nghiệp chlorine – kiềm là điện phân dung dịch sodium chloride bão hòa trong bể điện phân có màng ngăn xốp. Phương trình hóa học của phản ứng điện phân dung dịch NaCl bão hòa trong bể điện phân có màng ngăn như sau:
2NaCl(aq) + 2H₂O(l) → 2NaOH(aq) + H₂(g) + Cl₂(g)
a) Khí thoát ra ở anode là H₂. Khí thoát ra ở cathode là Cl₂.
b) Nếu không có màng ngăn xốp, nước Javel được hình thành trong bề điện phân.
c) Trong trường hợp không có màng ngăn, khi điện phân hoàn toàn dung dịch chứa 500 kg NaCl bão hòa ở 25°C thì thu được dung dịch chứa NaClO có nồng độ 30%. (Biết độ tan của NaCl ở nhiệt độ này là 36,2 gam/100 gam H₂O).
d) Sản phẩm cơ bản của công nghiệp chlorine – kiềm là sodium hydroxide, chlorine và hydrogen.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
Câu 23: Một mẫu nước thải của nhà máy sản xuất có pH = 3. Để thải ra ngoài môi trường thì cần phải tăng pH lên từ 5,8 đến 8,6 (theo đúng qui định), nhà máy phải dùng vôi sống thả vào nước thải. Để nâng pH của 4 m³ nước thải từ 3 lên 7 cần dùng m gam vôi sống. Tính giá trị m. (Bỏ qua sự thủy phân của các muối, kết quả làm tròn đến hàng đơn vị).
Câu 24: Ethylene được ứng dụng rộng rãi trong việc sản xuất bao bì, dệt may, điện tử, vận chuyển. Sử dụng cho ngành chất dẫn xuất và ngành hóa dầu. Ethylene tham gia vào các phản ứng tạo ra hóa chất, tổng hợp các chất hữu cơ như: ethylene glycol, ethanol, …
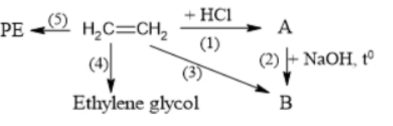
Sơ đồ dưới đây tổng hợp một số chất hữu cơ từ ethylene. Biết rằng A, B đều là các chất hữu cơ. Cho các phát biểu sau:
(a) Phản ứng (5) thuộc loại phản ứng trùng ngưng.
(b) Hợp chất hữu cơ B là CH₃CH₂OH.
(c) Tên thay thế của chất A là ethyl chloride.
(d) Các phản ứng (1), (3), (4) đều là phản ứng oxi hoá – khử.
Có bao nhiêu phát biểu đúng?
Câu 25: Cho các thí nghiệm sau:
(1) Cho dung dịch AgNO₃ vào dung dịch HCl thấy xuất hiện kết tủa màu trắng.
(2) Sục từ từ khí CO₂ đến dư vào dung dịch Ca(OH)₂ thấy xuất hiện kết tủa trắng, sau đó kết tủa tan.
(3) Cho từ từ đến dư dung dịch NaOH vào dung dịch Al₂(SO₄)₃, thu được kết tủa keo trắng, sau đó kết tủa tan.
Trong các thí nghiệm trên, có bao nhiêu thí nghiệm mô tả đúng hiện tượng hóa học xảy ra?
Câu 26: Cho các phát biểu sau:
(1) Phân tử Valine có 5 nguyên tử C.
(2) Có thể dùng nước bromine để phân biệt glucose và fructose.
(3) Ứng với CTPT C₃H₇O₂N có 2 đồng phân amino acid.
(4) Protein dạng hình cầu như albumin có thể tan trong nước cho dung dịch keo.
Liệt kê các phát biểu đúng theo số thứ tự tăng dần.
Câu 27: Khi con người sử dụng đồ uống có cồn như rượu, bia, … (có chứa ethanol), dưới tác dụng của hai loại enzyme alcohol dehydrogenase (ADH) và aldehyde dehydrogenase (ALDH) trong gan, có chuyển hóa như sau:
CH₃CH₂OH (ADH) → CH₃CHO (ALDH) → CH₃COOH
Thông thường, khi một người sử dụng đồ uống có cồn, có 10% ethanol được thải ra ngoài qua mồ hôi, hơi thở và nước tiểu; 90% ethanol được hấp thụ, chuyển hóa hết thành acetaldehyde (CH₃CHO) tại gan nhờ hệ thống enzyme. Nếu một người uống hai lon bia, mỗi lon dung tích 330 mL và nồng độ cồn của bia là 5% thì khối lượng CH₃CHO sinh ra tại gan là bao nhiêu gam? Biết khối lượng riêng của C₂H₅OH là 0,789 g/mL và nồng độ cồn của bia được tính theo số mL ethanol trong 100 mL bia. (chỉ làm tròn ở phép tính cuối cùng, kết quả làm tròn đến hàng phần mười).
Câu 28: Bộ phận quan trọng nhất của máy tạo nhịp tim là một hệ pin điện hóa lithium – iodine (gồm hai cặp oxi hóa khử Li⁺/Li và I₂/2I⁻). Hai điện cực được đặt vào tim, phát sinh dòng điện nhỏ kích thích tim đập ổn định. Cho biết: E°Li⁺/Li = -3,04V; E°I₂/2I⁻ = +0,54V; nguyên tử khối của Li = 6,9; điện lượng (q) của pin điện hoá được xác định bởi biểu thức: q = I.t = ne.F. Trong đó: I là cường độ dòng điện (A), t là thời gian pin hoạt động (giây), F là hằng số Faraday, F = 96485 C/mol, ne là số mol electron trao đổi giữa hai điện cực, 1 năm = 365 ngày. Cho các phát biểu sau:
(1) Máy tạo nhịp tim có thể được đặt tạm thời hay đặt một thời gian dài trong cơ thể tùy theo tình trạng sức khỏe và các bệnh lý kèm theo của bệnh nhân.
(2) Khi pin hoạt động lithium đóng vai trò là anode, tại anode xảy ra quá trình oxi hóa lithium.
(3) Sức điện động chuẩn của pin = 3,58V.
(4) Nếu pin tạo ra một dòng điện ổn định bằng 2,5.10⁻⁵ (A) thì một pin được chế tạo bởi 0,5 gam lithium có thể hoạt động tối đa trong thời gian 7 năm.
Số phát biểu đúng là bao nhiêu?
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




