Đề thi thử Đại học 2025 môn Hóa học – Sở GDĐT Quảng Nam là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, thuộc chương trình Đề thi vào Đại học.
Đề thi bám sát cấu trúc minh họa của Bộ GD&ĐT năm 2025, tập trung vào các chuyên đề trọng tâm như: este – lipit, amino axit – protein, polime, kim loại, phản ứng vô cơ – hữu cơ và các bài toán tính nhanh. Đây là tài liệu hữu ích giúp học sinh luyện tập, củng cố kiến thức và làm quen với áp lực phòng thi.
Hãy cùng Dethitracnghiem.vn khám phá và thử sức với đề thi này ngay bây giờ!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 SỞ GDĐT QUẢNG NAM





*Cho biết nguyên tử khối: H = 1; C = 12; N = 14; O = 16; S = 32; Cl = 35,5 ; K = 39; Ca = 40; Cr = 52; Mn = 55; Fe = 56; Cu = 64;
PHẦN I. Trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Thể điện cực chuẩn của một số kim loại Cr, Mn, Fe và Cu lần lượt là -0,408V; 1,57V; 0,771V và 1,97V. Kim loại nào thay đổi trạng thái oxi hóa từ +2 lên +3 dễ nhất?
A. Mn.
B. Fe.
C. Cr.
D. Cu.
Câu 2: Tỉ lệ giữa khí 18, chloroform chủ yếu sử dụng làm chất gây mê. Hơi chloroform ảnh hưởng đến hệ thần kinh trung ương của người bệnh, gây ra chóng mặt, mỏi mệt và ngất, cho phép bác sĩ phẫu thuật. Công thức phân tử chloroform là
A. CCl4.
B. CH2Cl2.
C. CHCl3.
D. CHCl3.
Câu 3: Cho bảng giá trị enthalpy tạo thành chuẩn của một số chất sau: butane khí (1); octane lỏng (2); propane khí (3); methane khí (4)

Một khu dân cư sử dụng khoảng 1,0.1011 kJ năng lượng mỗi ngày. Giả sử, tất cả năng lượng đó đến từ quá trình đốt cháy một trong các nhiên liệu sau: octane lỏng (C8H18) hoặc khí propane (C3H8) hoặc butane (C4H10) hoặc khí methane (CH4) để tạo thành hơi nước và khí carbon dioxide.
Dựa vào lượng khí CO2 (mol) thải ra khi tiêu thụ một nhiên liệu có thể đánh giá mức độ ảnh hưởng của nhiên liệu đó đến sự nóng lên toàn cầu.
Mức độ ảnh hưởng đến sự nóng lên toàn cầu của các loại nhiên liệu trên theo chiều hướng tăng dần là
A. (2) < (4) < (3) < (1).
B. (2) < (1) < (3) < (4).
C. (4) < (3) < (1) < (2).
D. (1) < (3) < (4) < (2).
Câu 4: Nước cứng không gây ra tác hại nào dưới đây?
A. Gây hao tốn nhiên liệu và không an toàn cho các nồi hơi, làm tắc các đường ống dẫn nước.
B. Gây ngộ độc nước uống.
C. Làm mất tính tẩy rửa của xà phòng, làm hư hại quần áo.
D. Làm hỏng các dung dịch pha chế, làm thực phẩm lâu chín và giảm mùi vị thực phẩm.
Câu 5: Đất sét polymer là một loại đất sét dựa trên poly(vinyl chloride) (PVC). Đất sét polymer không chứa khoáng chất đất sét, nhưng khi trộn PVC với một chất lỏng sẽ thu được vật liệu giống như đất sét; do đó, thường được gọi là đất sét và được dùng để làm đồ chơi, đồ thủ công, đồ trang trí. Các ứng dụng này dựa trên tính chất nào của PVC?
A. Tính không độc hại.
B. Tính cứng.
C. Tính dẻo dai.
D. Tính dẻo.
Câu 6: Trong pin Galvani Zn-Cu,
A. điện cực anode là Zn.
B. điện cực cathode là Zn.
C. điện cực anode là Cu.
D. điện cực âm là Cu.
Câu 7: Trong cây mía, củ cải đường, quả thốt nốt có chứa loại đường nào sau đây?
A. Glucose.
B. Saccharose.
C. Maltose.
D. Fructose.
Câu 8: Tính chất và đại lượng nào sau đây của kim loại kiềm biến đổi theo xu hướng số rệt?
A. Giá trị thế điện cực chuẩn, bán kính nguyên tử, độ cứng.
B. Tính khử, khối lượng riêng, độ cứng, nhiệt độ nóng chảy.
C. Tính oxi hóa, khối lượng riêng, nhiệt độ nóng chảy.
D. Tính khử, bán kính nguyên tử, độ cứng, nhiệt độ nóng chảy.
Câu 9: Cấu trúc ngành công nghệ sinh học và Công nghệ nano (IBN) của Singapore, với phần liên hệ với đời sống và sản xuất. Biến đổi hóa học glucose thành adipic acid như sau:
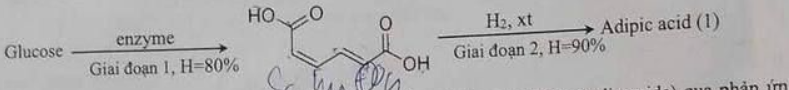 Trong công nghiệp, adipic acid được dùng để sản xuất poly(hexamethylene adipamide) qua phản ứng trùng ngưng giữa hexamethylenediamine và adipic acid với hiệu suất đạt 90%.
Trong công nghiệp, adipic acid được dùng để sản xuất poly(hexamethylene adipamide) qua phản ứng trùng ngưng giữa hexamethylenediamine và adipic acid với hiệu suất đạt 90%.
Trong các phát biểu sau:
a) Poly(hexamethylene adipamide) thuộc loại tơ polyamide.
b) Poly(hexamethylene adipamide) kém bền với acid và kiềm.
c) Poly(hexamethylene adipamide) có tên gọi khác là nylon-6,6.
d) Lượng adipic acid được tạo từ 225 kg glucose theo sơ đồ (1) có thể sản xuất được 179 kg nylon-6,6. Biết lượng cần dùng để sản xuất nylon-6,6 là vừa đủ và hiệu suất phản ứng là 92%.
Các phát biểu đúng là
A. (a), (b), (c).
B. (a), (b), (d).
C. (a), (b), (c), (d).
D. (b), (c), (d).
Câu 10: Cảnh sát giao thông sử dụng các dụng cụ phân tích ethanol (rượu ethylic) có chứa CrO3. Khi tài xế hà hơi thở vào dụng cụ phân tích trên, nếu trong hơi thở có chứa hơi rượu thì hơi rượu sẽ tác dụng với CrO3 có màu da cam và biến thành Cr2O3 có màu xanh lục. Tốc độ này được biểu diễn bằng phương trình hóa học sau:
2CrO3 (màu da cam) + 3C2H5OH -> Cr2O3 (màu lục sẫm) + 3CH3COOH + 3H2O
Các phát biểu sau:
a) Dựa vào sự biến đổi màu sắc mà dùng cụ phân tích sẽ thông báo cho cảnh sát biết được mức độ sử dụng rượu của tài xế.
b) Trong phản ứng trên, C2H5OH là chất khử. thông đường bộ là ô tô, xe mô tô, xe gắn máy, xe máy kéo, xe máy chuyên dùng hay xe đạp, xe đạp máy đều có thể bị Cảnh sát giao thông tạm giữ xe vì lỗi vi phạm nồng độ cồn theo Nghị định 100/2019/NĐ-CP của Chính phủ quy định.
d) Một lái xe thổi 50 ml khí thở vào máy đo nồng độ cồn, thấy tạo ra 0,0912 miligam chất rắn màu lục rồi. Nồng độ cồn có trong khí thở của lái xe đó là 0,552 miligam/lít.
Các phát biểu đúng là
A. (a), (b), (c).
B. (b), (c).
C. (a), (c).
D. (b), (d).
Câu 11: Khi bị ốm, mất sức hoặc sau các ca phẫu thuật, nhiều người bệnh thường được truyền dịch để cơ thể sớm hồi phục. Chất trong dịch truyền có tác dụng trên là
A. amine.
B. sodium chloride.
C. glucose.
D. saccharose.
Câu 12: M là nguyên tố kim loại chuyển tiếp dãy thứ nhất, có một số đặc điểm sau:
Ở trạng thái cơ bản, nguyên tử M có 1 electron ở lớp ngoài cùng. 1s² 2s² 2p⁶ 3s² 3p⁶ 3dⁿ 4s¹.
Trong hợp chất, số oxi hóa phổ biến của nguyên tử M là +2.
M là nguyên tố nào sau đây?
A. Mn.
B. Ni.
C. Cu.
D. Fe.
Câu 13: Pin mặt trời bao gồm nhiều tế bào quang điện làm biến đổi năng lượng ánh sáng thành năng lượng điện. Nhược điểm của loại pin này là
A. chi phí trang bị cao.
B. khó di chuyển.
C. thân thiện với môi trường.
D. thời gian sử dụng dài.
Câu 14: Ester ethyl propionate có mùi thơm của quả dứa chín. Công thức của ethyl propionate là
A. C3H7COOC2H5.
B. C2H5COOCH3.
C. C2H5COOC2H5.
D. CH3COOC2H5.
Câu 15: Loại polymer nào sau đây thuộc loại tơ?
A. Cao su buna.
B. Nylon-6,6.
C. PS.
D. PVC.
Câu 16: Một nhóm học sinh được giao nhiệm vụ khảo sát sự thay đổi tốc độ phản ứng của calcium carbonate với dung dịch hydrochloric acid theo thời gian. Học sinh tiến hành thí nghiệm như sau: Cho 4 gam calcium carbonate (dạng bột) phản ứng với 100 mL dung dịch HCl 0,1 M. Thể tích khí carbon dioxide được đo và ghi lại trong bảng sau:
 Cho các phát biểu sau:
Cho các phát biểu sau:
a) Tốc độ phản ứng thay đổi theo thời gian vì có va chạm giữa các chất phản ứng ít dần.
b) Với kết quả thí nghiệm trên, có thể kết luận thời gian phản ứng càng tăng thì thể tích khí carbon dioxide tạo ra càng nhiều.
c) Phản ứng giữa calcium carbonate với dung dịch hydrochloric acid là phản ứng xảy ra hoàn toàn.
d) Phản ứng dừng lại vì calcium carbonate phản ứng hết.
Các phát biểu đúng là
A. (a), (b).
B. (a), (b), (c).
C. (c).
D. (d), (a).
Câu 17: Ammonia có nhiều ứng dụng quan trọng trong đời sống và sản xuất. Trong công nghiệp, ammonia được tổng hợp từ nitrogen và hydrogen theo phương trình phản ứng:
N2(g) + 3H2(g) <=> 2NH3(g) (1)
Kết quả nghiên cứu sự phụ thuộc của hiệu suất phản ứng tổng hợp ammonia vào áp suất và nhiệt độ được thể hiện trong giản đồ sau:
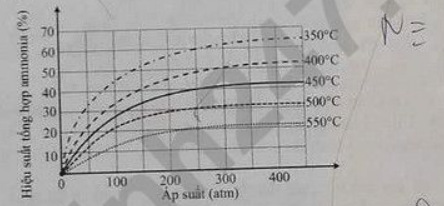 Cho các phát biểu sau:
Cho các phát biểu sau:
a) Hiệu suất của phản ứng ở 500°C, 300 atm cao hơn hiệu suất ở 450°C, 200 atm.
b) Khi tăng áp suất thì cân bằng của phản ứng (1) chuyển dịch theo chiều thuận.
c) Phản ứng (1) thực hiện ở nhiệt độ cao nên là phản ứng thu nhiệt.
d) Ở nhiệt độ 500°C, 250 atm, 2 mol N2 tác dụng với 3 mol H2 thu được 0,6 mol NH3.
Các phát biểu đúng là
A. (a), (c).
B. (a), (b).
C. (c).
D. (b), (d).
Câu 18: Muối nào sau đây có độ tan trong nước nhỏ nhất?
A. CaCO3.
B. MgSO4.
C. MgCO3.
D. BaSO4.
PHẦN II. Trắc nghiệm tự chấm điểm. Thí sinh chỉ trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1: Trong vỏ Trái Đất, sắt và nhôm là hai nguyên tố kim loại có hàm lượng cao hơn so với các nguyên tố kim loại khác.
a) Sắt hoặc nhôm đều được sử dụng với vai trò là kim loại cơ bản trong sản xuất các hợp kim nặng.
b) Từ quặng bauxite sẽ tách được sắt bằng phương pháp điện phân.
c) Khí trơng một lớp kẽm lên đỉnh tháp sẽ hạn chế được sự ăn mòn sắt trong thép theo phương pháp điện hóa.
d) Nhiệt độ cần để tái chế thép cao hơn nhiệt độ cần để tái chế nhôm.
Câu 2: Một nhóm học sinh tiến hành thí nghiệm về ăn mòn của kim loại (đinh thép). Nhóm học sinh đưa ra giả thuyết: “Sự ăn mòn kim loại không xảy ra nhanh hay chậm chỉ phụ thuộc vào các chất có trong môi trường”
Thí nghiệm được tiến hành theo các bước sau:
(Hình vẽ 4 cốc thí nghiệm)
Bước 1: Cho vào cốc 1, cốc 2, cốc 3, cốc 4 mỗi cốc 50 mL dung dịch NaCl bão hòa (nồng độ khoảng 5,3 M).
Bước 2: Đặt vào cốc 1 đinh thép được rửa sạch và để khô. Đặt vào cốc 2, cốc 3, cốc 4 mỗi cốc 1 đinh thép được rửa sạch, để khô và quấn vào đinh thép tương ứng một đoạn dây kẽm (cốc 2), một đoạn dây đồng (cốc 3). Đặt vào cốc 4 một lượng vừa đủ dầu hỏa sao cho lớp dầu hỏa phủ kín bề mặt dung dịch trong cốc.
Bước 3: Quan sát hiện tượng xảy ra trong 4 cốc trong khoảng 5 ngày, kết quả được ghi lại trong bảng sau:
(Table: Cốc vs Hiện tượng)
a) Ở cốc 1, khi nhúng đinh vào nước muối, sắt bị ăn mòn hóa học.
b) Ở cốc 2, khi quấn kẽm vào đinh thép rồi ngâm chúng trong dung dịch NaCl, xuất hiện hiện tượng ăn mòn điện hóa, kẽm có tính khử mạnh hơn sắt nên kẽm bị ăn mòn, do đó đinh thép được bảo vệ.
c) Quán một dây đồng quanh đinh thép là cách để chống ăn mòn đinh thép trong môi trường có chất điện lí. Đ/S
d) Với kết quả thí nghiệm như trên, giả thuyết của nhóm học sinh là đúng.
Câu 3: Hai ống nghiệm (1) và (2) đều chứa 1 mL dung dịch copper(II) sulfate 0,5% màu xanh nhạt. Tiến hành hai thí nghiệm sau ở 20°C.
Thí nghiệm 1: Thêm từ từ đến hết 2 mL dung dịch hydrochloric acid đặc (nồng độ khoảng 11 M) vào ống nghiệm (1). Quan sát màu sắc dung dịch.
Thí nghiệm 2: Thêm từ từ cho đến hết 2 mL dung dịch sodium chloride bão hòa (nồng độ khoảng 5,3 M) vào ống nghiệm (2). Quan sát màu sắc dung dịch.
(Phản ứng: Cu(H2O)6]2+(aq) + 4Cl-(aq) <=> [CuCl4]2-(aq) + 6H2O(l); Kc = 4,18 . 10⁵)
a) Trong thí nghiệm (1), phức chất [CuCl4]2- kém bền hơn phức chất [Cu(H2O)6]2+.
b) Trong thí nghiệm (2), không có dấu hiệu của phản ứng hình thành phức chất.
c) Khả năng thay thế phối tử trong phức chất [Cu(H2O)6]2+ không phụ thuộc vào nồng độ của ion Cl- trong dung dịch mà phụ thuộc vào tính acid mạnh của hydrochloric acid. Đ/S
d) Khi cho dung dịch HCl có nồng độ khoảng 3,3 M vào dung dịch copper(II) sulfate 0,5% thì không quan sát thấy dấu hiệu của phản ứng tạo thành phức chất [CuCl4]2-.
Câu 4: Thủy phân hoàn toàn tripeptide X (xúc tác enzyme) thu được dung dịch Y chứa các amino acid gồm: Glu, Gly và Lys. Điều chỉnh dung dịch Y về pH = 6, tại đó các amino acid tồn tại dưới dạng sau:
(Hình vẽ các dạng ion của Glycine, Lysine, Glutamic acid tại pH=6)
a) Ở điều kiện trên, các amino acid Glu, Gly và Lys đều là chất rắn, không màu khi ở dạng kết tinh. Đ/S
b) Trong các amino acid Glu, Gly và Lys, chỉ có 1 chất làm quỳ tím hóa xanh. Đ/S
c) Có 2 amino acid trong hỗn hợp Y bị dịch chuyển về phía cực dương. Đ/S
d) X có 3 công thức cấu tạo khác nhau và X tác dụng được hợp chất màu vàng với nitric acid. Đ/S
PHẦN III. Trắc nghiệm tự luận. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: Thủy phân một chất béo X (trong môi trường acid) thu được stearic acid và palmitic acid có tỉ lệ mol 2:1 và glycerol. Số đồng phân cấu tạo của X thỏa mãn đặc điểm trên? (Handwritten: 5)
Câu 2: Cho các chất sau: glucose, fructose, maltose, saccharose và tinh bột. Trong số các chất trên, có bao nhiêu chất vừa tạo hợp chất màu xanh lam với Cu(OH)2/NaOH, vừa tạo kết tủa Ag với thuốc thử Tollens và làm mất màu nước bromine? (Handwritten: 2)
Câu 3: Hấp phụ là khả năng của vật liệu tạo liên kết và giữ các chất trên bề mặt của nó. Đối với dầu thô, trong điều kiện yếm khí (thiếu oxygen) dầu thô được phân rã, gọi là tinh dầu. Loại than này có cấu trúc xốp, diện tích bề mặt lớn nên có khả năng hấp phụ cao.
Để đánh giá khả năng hấp phụ ion kim loại chì của than tòn tính so với cát, một nhóm học sinh đã thử nghiệm trên mỗi loại chất này với các vật liệu hấp phụ (100 gam cát hoặc 100 gam cát và 15 gam than tòn tính) theo sơ đồ thiết bị được dãy với tốc độ dòng chảy 0,33 lít/phút. Phản ứng xảy ra trong sơ đồ là dầu thô đi qua cột vật liệu. Lượng ion chì còn lại sau khi hấp phụ được xác định bằng dung dịch đi ra khỏi cột.
(Sơ đồ thiết bị xử lý nước)
Kết quả thí nghiệm được ghi lại trong bảng sau:
(Table: Thể tích nhiễm chì được xử lý (lít) vs Mức độ hấp phụ của cát (A1%), Mức độ hấp phụ của hỗn hợp cát và than (A2%))
Dựa vào kết quả thí nghiệm trên, tại cuối thời điểm xử lý 8 lít nước nhiễm ion kim loại chì, mức độ hấp phụ ion kim loại chì của 15 gam than tòn tính là? (Làm tròn kết quả đến hàng phần mười)
Câu 4: Cho các cặp oxi hóa – khử và thế điện cực chuẩn tương ứng:
(Table: Cặp oxi hóa – khử vs Thế điện cực chuẩn (V))
a) Xét ở điều kiện chuẩn, cho các phát biểu sau:
(1) Tính oxi hoá tăng dần theo thứ tự Mg2+, Zn2+, Sn2+, Fe2+, Ag+.
(2) Kim loại Mg tác dụng được với nước.
(3) Các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Ag; Fe và Zn; Fe và Sn; Fe và Mg. Khi nhúng các cặp kim loại trên vào dung dịch acid, số cặp kim loại trong đó Fe bị phá huỷ trước là 1.
(4) Có 1 kim loại không phản ứng với hydrochloric acid ở điều kiện thường.
Liệt kê các phát biểu đúng (theo thứ tự tăng dần)?
Câu 5: Chuẩn độ dung dịch FeSO4 bằng dung dịch KMnO4. Chuẩn độ dung dịch FeSO4 bằng dung dịch KMnO4 đã biết nồng độ (đựng trong buret). Trong quá trình chuẩn độ, nếu dung dịch trong buret được thêm vào dung dịch cần chuẩn độ quá nhanh thì trong buret sẽ xuất hiện kết tủa MnO2 theo phương trình hóa học dưới đây, dẫn đến sai lệch kết quả chuẩn độ:
MnO4-(aq) + H+(aq) + Fe2+(aq) -> MnO2(s) + Fe3+(aq) + H2O(l)
Giả sử một học sinh thao tác chuẩn độ sai, làm 55% lượng MnO4- chuẩn độ chuyển thành MnO2 (phần còn lại vẫn phản ứng tạo Mn2+). Tổng lượng Fe2+ bị oxi hóa là 2,4 mmol. Thể tích dung dịch KMnO4 0,02M đã dùng tăng bao nhiêu mL so với khi chuẩn độ với thao tác phù hợp? (Kết quả làm tròn đến hàng phần trăm).
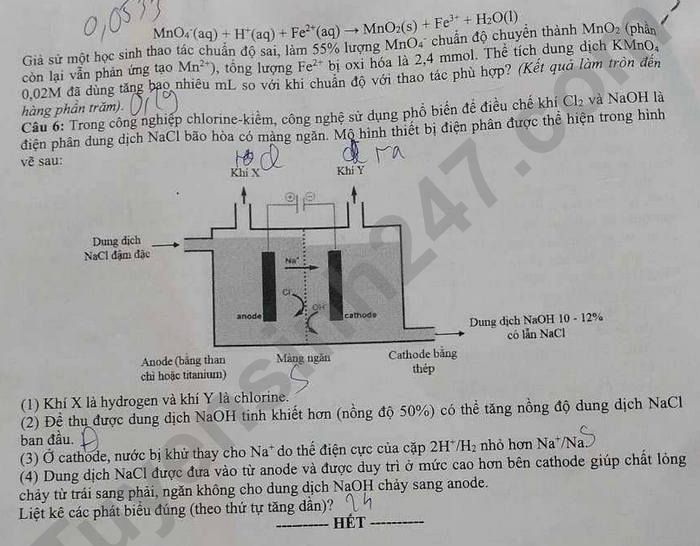
Câu 6: Trong công nghiệp chlorine-kiềm, công nghệ sử dụng phổ biến để điều chế khí Cl2 và NaOH là sử dụng dung dịch NaCl bão hòa có màng ngăn. Mô hình thiết bị điện phân được thể hiện trong hình vẽ sau:
(Hình vẽ thiết bị điện phân)
(1) Khí X là hydrogen và khí Y là chlorine.
(2) Để thu được dung dịch NaOH tinh khiết hơn (nồng độ khoảng 50%) có thể tăng nồng độ dung dịch NaCl ban đầu.
(3) Ở cathode, nước bị khử thay cho Na+ do thế điện cực của cặp 2H+/H2 nhỏ hơn Na+/Na.
(4) Dung dịch NaCl được đưa vào từ anode và được duy trì ở mức cao hơn bên cathode giúp chất lỏng chảy từ trái sang phải, ngăn không cho dung dịch NaOH chảy sang anode.
Liệt kê các phát biểu đúng (theo thứ tự tăng dần)?
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




