Đề thi thử Đại học 2025 môn Hóa học – THPT Lê Thánh Tông – TP Hồ Chí Minh (Tháng 3) là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, nằm trong chương trình Đề thi vào Đại học.
Đề thi được xây dựng sát với cấu trúc đề minh họa 2025 của Bộ GD&ĐT, tập trung vào các chuyên đề then chốt như: Este – Lipit, Amin – Amino axit, Cacbohiđrat, Kim loại, Phi kim và Hóa học đại cương. Với độ phân hóa hợp lý và cách hỏi bám sát thực tiễn, đề giúp học sinh kiểm tra năng lực toàn diện và chuẩn bị tốt cho kỳ thi chính thức.
Hãy cùng Dethitracnghiem.vn khám phá đề thi này và bắt đầu luyện tập hiệu quả ngay hôm nay!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 THPT LÊ THÁNH TÔNG – TP.HCM (THÁNG 3)
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Điện phân nóng chảy potassium chloride với các điện cực trơ để điều chế kim loại potassium (K). Quá trình xảy ra ở cathode là :
A. oxi hóa ion K⁺.
B. khử ion Cl⁻.
C. khử ion K⁺.
D. oxi hóa ion Cl⁻.
Câu 2: Hoá chất nào sau đây làm mềm được nước cứng vĩnh cửu ?
A. NaCl.
B. Na₂SO₄.
C. Na₂CO₃.
D. HCl.
Câu 3: Trong công nghiệp thực phẩm, để tạo hương dứa cho bánh kẹo người ta dùng ester X có công thức cấu tạo CH₃CH₂COOC₂H₅.Tên gọi của X là :
A. methyl propionate.
B. ethyl propionate.
C. methyl acetate.
D. propyl acetate.
Câu 4: Tinh bột chứa hỗn hợp chất nào sau đây ?
A. Glucose và fructose.
B. Amylose và amylopectin.
C. Glucose và galactose.
D. Amylose và cellulose.
Câu 5: Có thể dùng tối đa bao nhiêu cách trong các cách sau đây để dập tắt đám cháy xăng dầu ?
(a) Dùng chăn thấm ướt; (b) Dùng cát;
(c) Dùng bình carbon dioxide; (d) Dùng nước;
(e) Dùng bình chữa cháy dạng bọt.
A. 2.
B. 4.
C. 5.
D. 3.
Câu 6: Thí nghiệm nào sau đây thu được kết tủa sau phản ứng ?
A. TN₁: Cho vào ống nghiệm (1) khoảng 1 ml dung dịch ethylamine 5%. Thêm tiếp từ từ 0,5 – 1 ml HCl 5%, vừa thêm vừa lắc ống nghiệm.
B. TN₂: Cho vào ống nghiệm (2) 5 giọt dung dịch FeCl₃ 3%. Thêm từ từ đến hết 2 ml dung dịch ethylamine 5%. Vừa thêm vừa lắc ống nghiệm.
C. TN₃: Cho vào ống nghiệm (3) 5 giọt dung dịch CuSO₄ 5%. Thêm từ từ đến hết 4 ml dung dịch ethylamine 5% (dùng dư). Vừa thêm vừa lắc ống nghiệm.
D. TN₄: Cho vào ống nghiệm (4) 1 ml dung dịch benzylamine. Thêm tiếp từ từ 0,5 – 1 ml nước bromine, vừa thêm vừa lắc ống nghiệm.
Câu 7: Một mẫu nước được thử nghiệm định tính để xác định sự có mặt của một số ion. Mẫu nước được cho vào 4 ống nghiệm, sau đó nhỏ mỗi loại thuốc thử vào mỗi ống nghiệm và ghi nhận hiện tượng như bảng dưới đây :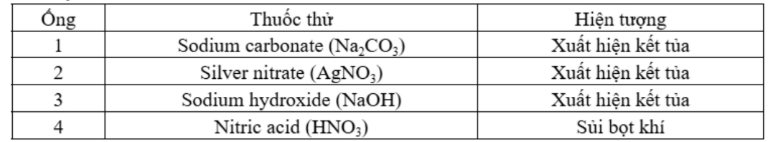 Mẫu nước trên có thể chứa những ion nào trong số các ion sau đây: (1) H⁺; (2) Ca²⁺; (3) Cl⁻; (4) HCO₃⁻; (5) CO₃²⁻?
Mẫu nước trên có thể chứa những ion nào trong số các ion sau đây: (1) H⁺; (2) Ca²⁺; (3) Cl⁻; (4) HCO₃⁻; (5) CO₃²⁻?
Α. (1), (2), (3).
Β. (3), (4), (5).
C. (2), (3), (5).
D. (2), (3), (4).
Câu 8: Phát biểu nào sau đây sai khi nói về enzyme ?
A. Phần lớn enzyme là những protein xúc tác cho các phản ứng hóa học và sinh hóa.
B. Tốc độ phản ứng có xúc tác enzyme thường nhanh hơn nhiều lần so với với xúc tác hóa học.
C. Tốc độ phản ứng có xúc tác enzyme thường chậm hơn nhiều lần so với với xúc tác hóa học.
D. Enzyme có tính chọn lọc cao, mỗi enzyme chỉ xúc tác cho một hoặc một số phản ứng nhất định.
Câu 9: Nguyên tử nguyên tố R có số electron là 25, vị trí của R trong bảng tuần hoàn là :
A. chu kì 4, phân nhóm VIIA.
B. chu kì 4, phân nhóm VIIB.
C. chu kì 4, phân nhóm VB.
D. chu kì 4, phân nhóm IIA.
Câu 10: Độ tan trong nước của các hydroxide nhóm IIA ở 20°C được cho ở bảng sau :
Phát biểu nào sau đây là sai ?
A. Mức độ phản ứng với nước của kim loại nhóm IIA có xu hướng tăng dần từ Be tới Ba.
B. Độ tan của các hydroxide nhóm IIA tăng dần từ Be(OH)₂ tới Ba(OH)₂.
C. Các kim loại nhóm IIA đều phản ứng mãnh liệt với nước ở 20°C theo phản ứng sau: M + 2H₂O → M(OH)₂ + H₂.
D. Ba(OH)₂ có độ tan lớn nhất nên dễ tách khỏi bề mặt kim loại, do đó Ba sẽ phản ứng với nước ngay điều kiện thường.
Câu 11: Cho phản ứng hóa học: Fe + CuSO₄ → FeSO₄ + Cu. Trong phản ứng trên xảy ra
A. sự oxi hóa Fe và sự khử Cu²⁺.
B. sự khử Fe²⁺ và sự khử Cu²⁺.
C. sự oxi hóa Fe và sự oxi hóa Cu.
D. sự khử Fe²⁺ và sự oxi hóa Cu.
Câu 12: Trong điều trị bệnh, sodium hydrogencarbonate còn được gọi là sodium bicarbonate được sử dụng dạng viên uống hoặc dung dịch truyền tĩnh mạch. Công thức của sodium hydrogencarbonate là
A. NaHCO₃.
B. Na₂CO₃.
C. NaHSO₃.
D. Na₂SO₄.
Câu 13: Cho các phát biểu sau:
(1) Tơ viscose, tơ acetate đều thuộc loại tơ tổng hợp.
(2) Polyethylene và poly(vinyl chloride) là sản phẩm của phản ứng trùng hợp.
(3) Tơ nylon-6,6 được điều chế từ hexamethylendiamine và stearic acid.
(4) Cao su thiên nhiên không tan trong nước cũng như trong xăng, benzene.
(5) Tơ nitron (olon) được tổng hợp từ vinyl cyanide (acrylonitrile).
Số phát biểu đúng là
A. 4.
B. 3.
C. 5.
D. 2.
Câu 14: Đặt hỗn hợp các amino acid gồm lysine, glycine và glutamic acid ở pH = 6,0 vào trong một điện trường thấy sự di chuyển như hình vẽ sau:
Cho các phát biểu sau:
a. Glycine hầu như không dịch chuyển.
b. Lysine dịch chuyển về phía cực âm.
c. Glutamic acid dịch chuyển về phía cực dương
d. Cả 3 amino acid đều không di chuyển.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 15: Acquy chì là một loại acquy đơn giản, gồm bản cực dương bằng PbO₂, bản cực âm bằng Pb, cả hai điện cực được đặt vào dung dịch H₂SO₄ loãng. Loại acquy này có thể sạc lại nhiều lần. Đây cũng là loại acquy được sử dụng phổ biến trên các dòng xe máy hiện nay với nhiều ưu điểm vượt trội. Acquy chì có các đặc điểm sau: (1) dễ sản xuất, giá thành thấp; (2) gây ô nhiễm môi trường; (3) có khả năng trữ một lượng điện lớn trong bình ắc quy; (4) hoạt động tương đối ổn định. Những ưu điểm của acquy chì là
Α. (1), (2), (3).
Β. (1), (3), (4).
C. (1), (2), (4).
D. (2), (3), (4).
Câu 16: Cho các cặp oxi hoá-khử của kim loại và thế điện cực chuẩn tương ứng:![]()
![]()
Số kim loại tác dụng được với dung dịch HCl ở điều kiện chuẩn, giải phóng khí H₂ là
A. 2.
B. 1.
C. 4.
D. 3.
Câu 17: Giá trị thế điện cực chuẩn của một số cặp oxi hóa – khử được xếp theo thứ tự tăng dần như sau: Fe²⁺/Fe, Cu²⁺/Cu, Fe³⁺/Fe²⁺, Ag⁺/Ag, Cl₂/2Cl⁻. Trong các chất sau: Cu, AgNO₃, Cl₂, chất tác dụng được với dung dịch Fe(NO₃)₂ là
A. chỉ có AgNO₃.
B. AgNO₃ và Cl₂.
C. chỉ có Cu.
D. chỉ có Cl₂.
Câu 18: Cho các phương trình hóa học đúng theo tỷ lệ mol như sau:
(1) X + 2NaOH → X₁ + X₂ + H₂O
(2) X₁ + H₂SO₄ → X₃ + Na₂SO₄
(3) nX₂ + nY → Poly(ethylene terephthalate) + 2nH₂O
(4) nX₃ + nZ → tơ nylon-6,6 + 2nH₂O
Phần trăm số nguyên tử oxygen trong X gần nhất với giá trị nào sau đây?
A. 42,1%.
B. 36,78%.
C. 33,33%.
D. 38,1%.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Câu 19: Ở 25°C, nhúng một thanh Zn vào cốc đựng dung dịch ZnSO₄ 1M, nhúng một thanh Cu vào cốc đựng dung dịch CuSO₄ 1M. Nối thanh Zn và thanh Cu bằng dây dẫn, lắp một vôn kế để đo hiệu điện thế. Đóng kín mạch bằng cầu muối chứa dung dịch bão hoà KNO₃. Biết E°Zn²⁺/Zn = -0,672 V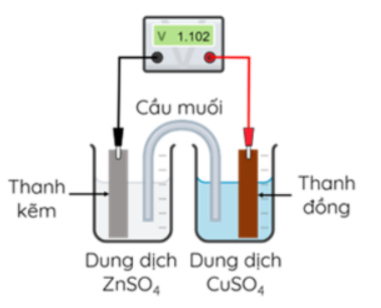
a) Tại cathode xảy ra quá trình oxi hoá: Cu → Cu²⁺ + 2e⁻.
b) Khi pin hoạt động các electron theo dây dẫn di chuyển từ thanh Zn sang thanh Cu
c) Thế điện cực chuẩn của Cu²⁺/Cu là 1,774 V.
d) Trong quá trình pin hoạt động, cation di chuyển tử bình đựng ZnSO₄ qua cầu muối sang bình đựng dung dịch CuSO₄, anion di chuyển từ bình đựng CuSO₄ qua cầu muối sang bình đựng ZnSO₄.
Câu 20: Phân tích nguyên tố hợp chất hữu cơ E cho kết quả phần trăm khối lượng carbon, hydrogen và oxygen lần lượt là 54,55%; 9,09% và 36,36%. Dựa vào phương pháp phân tích khối phổ (MS) xác định được phân tử khối của E là 88. Thuỷ phân hoàn toàn E trong dung dịch NaOH, thu được muối của carboxylic acid X và chất Y. Chất Y có nhiệt độ sôi (64,7°C) nhỏ hơn nhiệt độ sôi của ethanol (78,3°C) (nhiệt độ sôi đều đo ở áp suất 1 atm).
(a) Công thức phân tử của E là C₄H₈O₂.
(b) Carboxylic acid X là propanoic acid.
(c) Chất Y được phối trộn với xăng RON 92 để tạo ra xăng sinh học.
(d) Chất E không thể được điều chế trực tiếp bằng phản ứng ester hoá.
Câu 21: Trong phòng thí nghiệm, một nhóm học sinh tìm hiểu phản ứng giữa kim loại đồng (copper) và dung dịch silver nitrate (AgNO₃). Giả thuyết của nhóm học sinh là “khi nhúng lá đồng trong dung dịch silver nitrate, lá đồng tan bớt, có kim loại bạc (silver) bám trên lá đồng”. Để kiểm tra giả thuyết này, nhóm học sinh đã thực hiện thí nghiệm như sau:
Cân một lá đồng, xác định được khối lượng là đồng ban đầu là 5,24 gam.
Nhúng lá đồng vừa cân được vào dung dịch silver nitrate.
Sau một thời gian lấy lá đồng ra, làm khô, cân lại thấy khối lượng lá đồng là 5,39 gam.
a. Đã có 0,15 gam kim loại bạc bám trên lá đồng.
b. Giả thuyết của nhóm học sinh là đúng.
c. Dung dịch từ không màu chuyển sang màu xanh.
d. Thí nghiệm trên chứng minh tính oxi hóa của ion Ag⁺ mạnh hơn tính oxi hóa của ion Cu²⁺.
Câu 22: Muối Mohr có công thức (NH₄)₂Fe(SO₄)₂.6H₂O. Để xác định độ tinh khiết của một loại muối Mohr (cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H₂SO₄ 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO₄ 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:

a. Dung dịch H₂SO₄ được thêm vào dung dịch chuẩn độ để tạo thành môi trường acid, giúp phản ứng xảy ra theo hướng tạo thành Mn²⁺.
b. Có thể thay dung dịch H₂SO₄ bằng dung dịch acid mạnh như HCl, HNO₃ nhưng phải đảm bảo lượng H⁺ dư sau phản ứng.
c. Trong mỗi lần chuẩn độ, dung dịch KMnO₄ được xem là phản ứng vừa đủ với muối Mohr (điểm dừng) khi giọt dung dịch KMnO₄ cuối cùng nhỏ vào dung dịch Y không mất màu.
d. Theo kết quả chuẩn độ ở trên, trong số các giá trị: 93,32; 98,45; 97,36; 99,87 độ tinh khiết (% khối lượng (NH₄)₂Fe(SO₄)₂.6H₂O) của muối Mohr có giá trị gần nhất với 98,45.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
Câu 23: Cho các polymer sau: polyethylene, poly(methyl metacrylate), poly(vinyl chloride), polyacrylonitrile. Có bao nhiêu polymer điều chế được bằng phản ứng trùng hợp?
Câu 24: Tiến hành các thí nghiệm sau:
(1) Điện phân MgCl₂ nóng chảy.
(2) Cho CO qua Fe₂O₃ đun nóng
(3) Nhiệt phân hoàn toàn CaCO₃.
(4) Cho kim loại Na vào dung dịch CuSO₄ dư.
(5) Dẫn khí H₂ dư đi qua bột CuO nung nóng.
Sau khi các phản ứng kết thúc, các thí nghiệm thu được kim loại được sắp xếp theo trình tự từ nhỏ đến lớn là bao nhiêu?
Câu 25: Từ 500 tấn quặng hematite chúra 85% Fe₂O₃ sản xuất được x nghìn chiếc nồi gang có hàm lượng sắt là 95%. Biết rằng mỗi chiếc nồi gang nặng 5 kg và hiệu suất của toàn bộ quá trình là 80%. Giá trị của x là bao nhiêu (kết quả làm tròn đến chữ số hàng đơn vị)?
Câu 26: Thành phần chủ yếu của xà phòng thường là muối sodium của palmitic acid hoặc stearic acid. Ngoài ra, trong xà phòng còn có chất độn (làm tăng độ cứng để đúc thành bánh), chất tẩy màu, chất diệt khuẩn và chất tạo hương,. Từ 3,5 tấn chất béo chứa 80% khối lượng tristearin (còn 20% tạp chất trơ bị loại bỏ trong quá trình nấu xà phòng) để sản xuất được m tấn xà phòng chứa 70% khối lượng sodium stearate. Giả sử hiệu suất toàn bộ quá trình là 90%. Giá trị của m bằng bao nhiêu tấn (kết quả làm tròn đến chữ số hàng phần trăm)?
Câu 27: Độ tan của Ca(OH)₂ trong nước ở 25°C là 0,17 gam/100 gam nước. Dung dịch bão hòa Ca(OH)₂ có khối lượng riêng là 1,02 g/mL. Giá trị pH của dung dịch Ca(OH)₂ bão hòa bằng bao nhiêu (kết quả làm tròn đến chữ số hàng phần mười)?
Câu 28: Thực hiện các thí nghiệm sau:
Thí nghiệm 1: Rót khoảng 2 mL dung dịch HCl vào ống nghiệm có một viên Zn sạch.
Thí nghiệm 2: Rót khoảng 2 mL dung dịch HCl vào ống nghiệm có một viên Zn sạch, sau đó thêm vài giọt dung dịch CuSO₄.
Thí nghiệm 3: Rót khoảng 2 mL dung dịch HCl vào ống nghiệm có một mẩu dây đồng.
Thí nghiệm 4: Rót khoảng 2 mL dung dịch HCl vào ống nghiệm có một viên Zn và một mẩu dây Cu tiếp xúc với nhau.
Số thí nghiệm xuất hiện ăn mòn điện hóa học trong 4 thí nghiệm trên?
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




