Đề thi thử Đại học 2025 môn Hóa học – THPT Quang Trung – Hải Phòng (Lần 1) là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, nằm trong chương trình Đề thi vào Đại học.
Đề thi được biên soạn theo chuẩn cấu trúc đề minh họa 2025 của Bộ GD&ĐT, tập trung kiểm tra các chuyên đề trọng tâm như: Este – Lipit, Amin – Amino axit, Cacbohiđrat, Kim loại, Phi kim và Hóa học đại cương. Đây là tài liệu hữu ích giúp học sinh rèn luyện kỹ năng phân tích đề, tư duy logic và phản xạ nhanh với các dạng bài nâng cao.
Hãy cùng Dethitracnghiem.vn khám phá ngay đề thi này để nâng cao năng lực và tự tin bước vào kỳ thi sắp tới!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 THPT QUANG TRUNG – HẢI PHÒNG (LẦN 1)
Phần I: Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Thủy phân triolein có công thức (C₁₇H₃₃COO)₃C₃H₅ trong dung dịch NaOH, thu được glycerol và muối X. Công thức của X là
A. C₁₇H₃₅COONa.
B. CH₃COONa.
C. C₁₇H₃₃COONa.
D. C₂H₅COONa.
Câu 2: Cho các cặp oxi hoá – khử và thế điện cực chuẩn tương ứng:

Phản ứng nào sau đây đúng?
A. Ni + Cr³⁺ → Ni²⁺ + Cr²⁺.
B. Zn + Cr³⁺ → Zn²⁺+ Cr²⁺.
C. Zn + 2Cr³⁺ → Zn²⁺ + 2Cr²⁺.
D. Zn + Cr²⁺ → Zn²⁺ + Cr.
Câu 3: X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến điện, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. 1s²2s²2p⁶3s²3p⁵.
B. 1s²2s²2p⁶3s²3p⁴.
C. 1s²2s²2p⁶3s²3p³.
D. 1s²2s²2p⁶3s²3p².
Câu 4: X là hợp chất dùng làm thuốc gây mê toàn thân theo đường thở. Nó cũng có tác dụng giảm đau và giãn cơ. Hợp chất hữu cơ X có phổ khối lượng. Hợp chất hữu cơ X có thể là
A. C₄H₁₀.
B. CH₂Cl₂.
C. C₄H₁₀O.
D. C₄H₈O₂.
Câu 5: Hợp chất nào sau đây là amine ?
A. CH₃NHCH₂CH₃.
B. HOCH₂COOH.
C. H₂NCH₂COOH.
D. H₂NCH₂COOCH₃.
Câu 6: Protein chiếm khoảng 20% cơ thể con người và xuất hiện trong thành phần của mọi tế bào. Thành phần phân tử protein nhất thiết phải có mặt 4 nguyên tố nào sau đây ?
A. C, H, O, S.
B. C, H, O, N.
C. C, H, N, P.
D. C, H, S, N.
Câu 7: Cho các cặp oxi hoá – khử và thế điện cực chuẩn tương ứng :

Phản ứng nào sau đây đúng ?
A. Ni + Cr³⁺ → Ni²⁺ + Cr²⁺.
B. Zn + Cr³⁺ → Zn²⁺+ Cr²⁺.
C. Zn + Cr³⁺ → Zn²⁺ + Cr.
D. Zn + Cr²⁺ → Zn²⁺ + Cr.
Câu 8: Cho mẫu sodium vào ống nghiệm đựng 3 mL chất lỏng X, thấy sodium tan dần và có khí thoát ra. Chất X là :
A. pentane.
B. benzene.
C. hexane.
D. ethanol.
Câu 9: Cyclodextrin gồm nhiều đơn vị đường α-D-glucopyranose liên kết với nhau tại liên kết α (1-4). Đây là chất có cấu trúc khoang rỗng, phía trong khoang ít phân cực và phía ngoài khoang phân cực mạnh, do đó có khả năng tạo phức với các dược chất kỵ nước. Khi kết nối nhiều phân tử cyclodextrin lại tạo một khoang giữ hoạt chất bên trong để hình thành “siêu phân tử”, làm tăng độ tan của hoạt chất. Đây là một thành tựu trong công nghệ nano, có ý nghĩa trong y học. Hình 1, 2 và 3 lần lượt thể hiện cấu trúc cyclohexadextrin, cấu trúc “siêu phân tử” và ứng dụng liên quan. 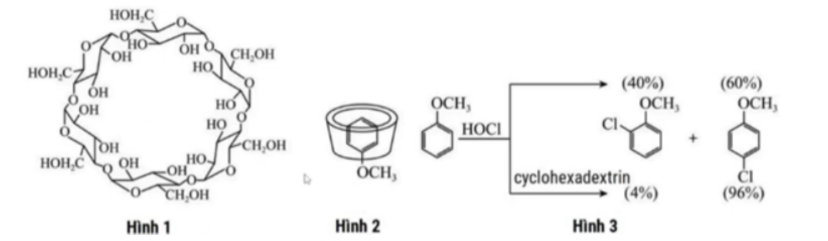
Trong các phát biểu sau, phát biểu nào sai ?
A. Hình 2 thể hiện khả năng giữ hoạt chất C₆H₅OCH₃ bên trong của cyclodextrin để hình thành “siêu phân tử”, làm tăng độ tan của hoạt chất.
B. Dựa vào Hình 3, có thể tách cyclodextrin ra khỏi hỗn hợp cyclodextrin và chloroanisole (bao gồm 2-chloromethoxybenzene và 4-chloromethoxybenzene) bằng phương pháp chiết.
C. Các loại dược chất không phân cực đều có thể đưa vào cyclohexadextrin để tạo thành cấu trúc “siêu phân tử”, từ đó có thể đưa được dược chất vào môi trường ưa nước trong cơ thể.
D. Cyclohexadextrin là một oligosaccharide (là chuỗi carbohydrate được tạo thành từ các monosaccharide).
Câu 10: Trong mật ong, carbohydrate có hàm lượng nhiều nhất (chiếm khoảng 40%) và làm cho mật ong có vị ngọt sắc là :
A. fructose.
B. tinh bột.
C. cellulose.
D. saccharose.
Câu 11: Biogas là một loại khí sinh học, được sản xuất bằng cách ủ kín các chất thải hữu cơ trong chăn nuôi, sinh hoạt. Biogas được dùng để đun nấu, chạy máy phát điện sinh hoạt gia đình. Thành phần chính của biogas là
A. CH₄.
B. NH₃.
C. CO₂.
D. N₂.
Câu 12: Chất nào dưới đây không có phản ứng tráng bạc khi cho phản ứng với thuốc thử Tollens?
A. Fructose.
B. Saccharose.
C. Maltose.
D. Glucose.
Câu 13: Trên hộp xốp cách nhiệt, hộp đựng thức ăn mang về, cốc, chén đĩa dùng một lần, thường được in kí hiệu như hình bên. Polymer dùng làm các đồ dùng đó được tổng hợp từ monomer nào sau đây?
A. CH₂=CHCH₃.
B. CH₂=CHC₆H₅.
C. CH₂=CHCl.
D. CH₂=CH₂.
Câu 14: Cho: E°Zn²⁺/Zn = -0,763 V; E°Ni²⁺/Ni = -0,257 V. Sức điện động chuẩn của pin Zn – Ni là
A. 0,506 V.
B. -0,506 V.
C. -0,465 V.
D. 0,465 V.
Câu 15: Các loại phân lân đều cung cấp cho cây trồng nguyên tố:
A. Phosphorus.
B. Carbon.
C. potassium.
D. Nitrogen.
Câu 16: Chất X là một trong những chất dinh dưỡng cơ bản của con người và một số động vật. Trong cơ thể người, X bị thủy phân thành chất Y nhờ các enzyme trong nước bọt và ruột non. Phần lớn Y được hấp thụ trực tiếp qua thành ruột vào máu đi nuôi cơ thể. Hai chất X,Y lần lượt là
A. tinh bột và fructose.
B. tinh bột và glucose.
C. cellulose và fructose.
D. saccharose và glucose.
Câu 17: Chất nào sau đây thuộc loại dẫn xuất halogen của hydrocarbon?
A. CH₃Cl.
B. C₂H₇N.
C. C₂H₅OH.
D. CH₃CHO.
Câu 18: Chất nào sau đây có thể dùng làm xà phòng?
A. CH₃[CH₂]₁₀CH₂OSO₃Na.
B. CH₃[CH₂]₁₆COOK.
C. CH₃[CH₂]₁₁CO₃Na.
D. C₂H₅COONa.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thi sinh chọn đúng hoặc sai.
Câu 19: Bằng cách sử dụng điện cực làm bằng Pt được biến tính thông qua các vật liệu khác nhau và chất điện giải NaBr, ta có được một chu trình kết hợp giữa quá trình điện phân và xúc tác để thu được H₂ và O₂ một cách có hiệu quả.
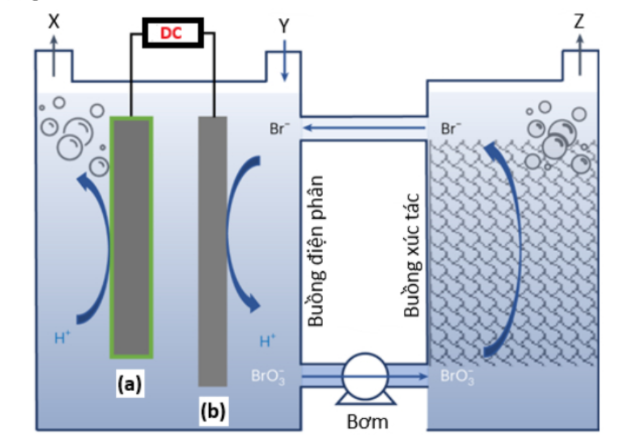
Sơ đồ thiết bị được mô tả như hình bên, biết quá trình xảy ra ở điện cực b như sau:
Br⁻ + 3H₂O → BrO₃⁻ + 6H⁺ + 6e⁻.
a) Tỉ lệ sản phẩm trong pha xúc tác là nZ : nBr = 3 : 2.
b) Điện cực a mắc vào cực âm của nguồn.
c) Phương trình của phản ứng trong bình điện phân của hệ là: Br⁻ + 3H₂O → BrO₃⁻ + 3H₂.
d) Mục đích của việc thêm Y là bổ sung NaBr.
Câu 20: Methyl cinnmate là một ester có công thức phân tử C₁₀H₁₀O₂ và có mùi thơm của dâu tây (strawberry) được sử dụng trong ngành công nghiệp hương liệu và nước hoa. Để điều chế 16,2 gam ester methyl cinnmate người ta cho 29,6 gam cinnamic acid phản ứng với lượng dư methyl alcohol (CH₃OH).
a) Methyl cinnmate có đồng phân hình học.
b) Methyl cinnmate có công thức cấu tạo là CH₃COO-CH=CH-C₆H₅.
c) Methyl cinnmate phản ứng với NaOH với tỉ lệ 1 : 2.
d) Hiệu suất phản ứng ester hóa trong trường hợp này là 50%.
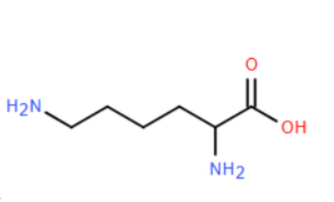
Câu 21: Lysine là một thành phần quan trọng của tất cả các protein trong cơ thể. Nó đóng vai trò quan trọng trong việc hấp thu canxi, tạo cơ bắp, phục hồi sau chấn thương hay sau phẫu thuật, sự tổng hợp các hormone, enzym, và các kháng thể. Lysine có công thức cấu tạo như sau:
a) Lysine là hợp chất hữu cơ đa chức và có công thức phân tử là C₆H₁₄O₂N₂
b) 1 mol lysine có thể phản ứng tối đa với 2 mol HCl.
c) Dung dịch lysine không làm đổi màu quỳ tím.
d) Điểm đằng điện của lysine pI = 9,74 (hay tại pH = 9,74 lysine tồn tại dạng ion lưỡng cực có tổng điện tích bằng 0). Đặt lysine ở pH = 6,0 vào trong một điện trường, lysine sẽ dịch chuyển về phía cực dương.
Câu 22: Hình ảnh dưới đây mô tả đoạn mạch cao su trước và sau khi lưu hóa
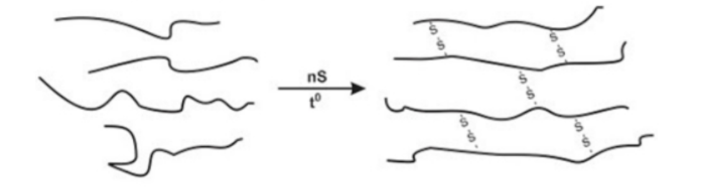
a. Phản ứng lưu hóa cao su thuộc loại phản ứng giữ nguyên mạch polymer.
b. Cao su sau khi được lưu hóa có tính đàn hồi và chịu nhiệt tốt hơn.
c. Cao su dùng để sản xuất lốp xe, chất dẻo, chất dẫn điện.
d. Ở cao su lưu hóa các mạch polymer chủ yếu được nối với nhau bằng cầu nối disulfide.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
Câu 23: Nitrogen là nguyên tố dinh dưỡng quan trọng cho sinh vật, tuy nhiên hàm lượng nitrogen cao có thể gây ô nhiễm nước. Một nghiên cứu xác định hàm lượng ion ammonium (NH₄⁺) trong nước bề mặt ở Đồng bằng Sông Cửu Long và so sánh với tiêu chuẩn (hàm lượng NH₄⁺ < 3 mg.L⁻¹) theo nguyên tắc sau:
– Chuẩn bị mẫu thử bằng cách pha loãng mẫu nước 10 lần.
– Ion NH₄⁺ được chuyển thành indophenol qua các phản ứng:
NH₄⁺ + ClO⁻ → NH₂Cl + H₂O; NH₂Cl (dẫn xuất phenol) → Indophenol (dung dịch A)
Cường độ màu (đậm nhạt) của dung dịch A tỉ lệ thuận với lượng indophenol trong dung dịch. Khi đó máy đo cường độ màu có thể tính toán được hàm lượng indophenol, từ đó tính được hàm lượng NH₄⁺ trong mẫu đo. Kết quả cho thấy hàm lượng ion NH₄⁺ trong mẫu thử là 1,44 mg.L⁻¹.
Các phản ứng cần thực hiện ở điều kiện pH trong khoảng từ 4 đến 13. Thiết bị chỉ đo được mẫu nước có hàm lượng NH₄⁺ nằm trong khoảng từ 0,26 đến 10,30 mg.L⁻¹.
Từ kết quả thí nghiệm, một số phát biểu được đưa ra như sau:
(1) Hàm lượng nguyên tố nitrogen cao trong nước có thể dẫn đến hiện tượng phú dưỡng, làm tăng nồng độ oxygen (O₂) hoà tan trong nước và gây ô nhiễm.
(2) Hàm lượng nguyên tố nitrogen tồn tại ở dạng NH₄⁺ trong mẫu thử trên là 1,12 mg.L⁻¹.
(3) Kết quả trên chứng tỏ lượng NH₄⁺ trong nước có nguồn gốc từ phân bón trên các đồng ruộng lân cận.
(4) Kết quả trên khẳng định được nitrogen trong nước không tồn tại ở dạng nitrate (NO₃⁻).
(5) Mục đích của thí nghiệm là để kiểm tra hàm lượng ion NH₄⁺ trong nước bề mặt có nằm ngoài tiêu chuẩn cho phép hay không.
(6) Hàm lượng NH₄⁺ trong mẫu nước ban đầu là 1,44 mg.L⁻¹.
Liệt kê các phát biểu đúng theo thứ tự tăng dần.
Câu 24: Cho peptide X có cấu trúc như hình sau:
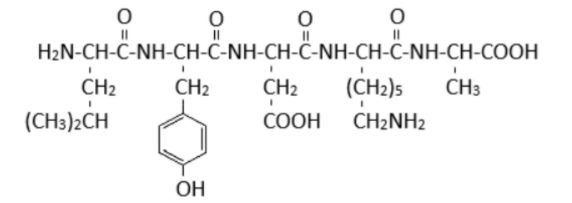
Tính số mol NaOH cần để tác dụng hoàn toàn với dung dịch chứa 0,1 mol X.
Câu 25: Tiến hành mạ niken (D = 8,9 g/cm³) lên 10 mẫu vật kim loại hình trụ (mỗi mẫu có bán kính 2,5 cm và cao 20,0 cm) bằng phương pháp mạ điện trong bể chứa dung dịch NiSO₄. Điện áp đặt lên các điện cực của bể mạ là 2,5V. Biết rằng, để đạt tiêu chuẩn thì lớp mạ niken phải phủ đều lên mỗi mẫu vật và có độ dày là 0,4 mm. Điện năng (kWh) phải tiêu thụ trong quá trình mạ điện trên là bao nhiêu, làm tròn đến hàng phần trăm?
Biết: π = 3,14; hiệu suất mạ điện là 90%; Ni = 58,7;
Điện năng A = U.q (q là điện lượng, 1 mol điện lượng = 96500C; 1kWh = 3,6.10⁶ J.
Câu 26: Peptide P được tách từ mô mỡ của tế bào động vật. Biết rằng:
(1) Bằng phương pháp sắc kí, người ta xác định được P có 20 mắt xích với tỉ lệ các amino acid như sau: Gly : Ala : Leu : Met : Lys : Trp : Phe : Arg : Ser = 2 : 4 : 4 : 2 : 2 : 1 : 3 : 1 : 1
(2) Bằng phương pháp Sanger cho thấy đơn vị amino acid đầu N là alanine.
(3) Thuỷ phân P nhờ enzyme carboxipeptidaza cho amino acid đuôi C là phenylalanine.
(4) Thủy phân P nhờ enzyme tripsin thu được 4 peptide có mạch ngắn hơn:
(I) Trp-Phe-Arg
(II) Leu-Gly-Leu-Leu-Phe
(III) Ala-Leu-Gly-Met-Lys
(IV) Ala-Ala-Ser-Met-Ala-Phe-Lys
(5) Phân cắt mạch P nhờ tác nhân BrCN, thu được 3 peptide:
(V) Ala-Phe-Lys-Leu-Gly-Leu-Leu-Phe
(VI) Ala-Leu-Gly-Met
(VII) Lys-Trp-Phe-Arg-Ala-Ala-Ser-Met
Khi xét peptide P, nếu tính từ amino acid đầu N ở vị trí thứ nhất thì amino acid Ser ở vị trí thứ mấy?
Câu 27: Sulfuric acid là một trong những hoá chất quan trọng nhất được sử dụng trong công nghiệp; được sản xuất hàng trăm triệu tấn mỗi năm, chiếm nhiều nhất trong ngành công nghiệp hoá chất. Phương pháp sản xuất sulfuric acid phổ biến nhất là phương pháp tiếp xúc, theo đó acid có thể được điều chế qua các giai đoạn sau:
(1) FeS₂(s) + O₂(g) → Fe₂O₃(s) + SO₂(g)
(3) H₂SO₄(aq) + SO₃(g) → H₂SO₄.nSO₃(l)
(2) SO₂(g) + O₂(s) ⇌ SO₃(g)
(4) H₂SO₄.nSO₃(l) + H₂O(l) → H₂SO₄(aq)
Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ 10,00 mL dung dịch acid này bằng dung dịch chuẩn NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Tổng số nguyên tử (có trong 1 phân tử oleum H₂SO₄.nSO₃ trên là bao nhiêu (làm tròn tới phần nguyên giá trị của n trong oleum)?
Câu 28: Cho các chất sau: Kim loại Na, nước bromine, dung dịch NaCl, dung dịch NaOH, dung dịch HNO₃ đặc (xúc tác H₂SO₄ đặc); dung dịch NaHCO₃; dung dịch Na₂CO₃. Số chất tác dụng được với phenol?
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




