Đề thi thử Đại học 2025 môn Hóa học – TP Đà Nẵng là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT, trong chương trình Đề thi vào Đại học.
Đề thi được biên soạn sát với đề minh họa 2025 của Bộ GD&ĐT, bao gồm đầy đủ các chuyên đề trọng tâm như: este – lipit, amino axit – protein, polime, kim loại, phản ứng vô cơ – hữu cơ, bài toán bảo toàn và nhận biết hóa chất. Với mức độ phân hóa tốt, đề giúp học sinh rèn luyện kỹ năng xử lý câu hỏi nhanh, chính xác và đánh giá năng lực toàn diện.
Hãy cùng Dethitracnghiem.vn bắt đầu luyện tập với đề thi này để chinh phục kỳ thi sắp tới!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 TP ĐÀ NẴNG



PHẦN I. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Cho biết dãy thế điện cực chuẩn của các cặp oxi hóa – khử sau: Ở điều kiện thường, trong các ion Fe³⁺, MnO₄⁻, Zn²⁺, Co³⁺ ion có tính oxi hóa mạnh nhất là
Ở điều kiện thường, trong các ion Fe³⁺, MnO₄⁻, Zn²⁺, Co³⁺ ion có tính oxi hóa mạnh nhất là
A. Fe³⁺
B. Zn²⁺
C. Co³⁺
D. MnO₄⁻
Câu 2: Chất nào sau đây phản ứng với axit nitric đặc (HNO₃) tạo thành 2-propan-1-ol. Tên gọi của X là
A. 2-propan-2-amine.
B. metylamin.
C. propan-1-amine.
D. etylamin.
Câu 3: Hai loại monosaccarit sau đây đều có phản ứng tráng bạc là
A. Saccarose.
B. Glucose.
C. Fructose.
D. Saccarose.
Câu 4: Khi đốt cháy hoàn toàn este X, thấy sản phẩm cháy gồm CO₂ và H₂O có số mol bằng nhau. Công thức cấu tạo của este X là
A. no, đơn chức.
B. no, đa chức.
C. không no, đơn chức.
D. no, đa chức.
Câu 5: Một loại nước cứng có chứa các ion sau: Mg²⁺, Ca²⁺, Cl⁻, SO₄²⁻, HCO₃⁻. Phương pháp hoặc chất không thể làm mềm loại nước cứng trên là
A. phương pháp trao đổi ion.
B. Na₂CO₃.
C. K₃PO₄.
D. HCl.
Câu 6: Nhôm là nguyên tố kim loại phổ biến nhất trên vỏ Trái Đất, tồn tại ở các dạng khoáng vật như đất sét, quặng bauxit, cryolit… Thành phần hóa học chính của quặng bauxit là
A. Al₂O₃.2H₂O.
B. KAl(SO₄)₂.12H₂O.
C. Al₂(SO₄)₃.18H₂O.
D. Na₃AlF₆.
Câu 7: Thủy phân tripeptit Y mạch hở thu được glycine, alanine và valine. Bằng các thí nghiệm thích hợp xác định được Y có COOH đầu C và NH₂ đầu N là glycine. Công thức cấu tạo của Y là
A. Gly-Ala-Val.
B. Val-Gly-Ala.
C. Val-Ala-Gly.
D. Ala-Gly-Val.
Câu 8: Phát biểu nào sau đây đúng?
A. Polymer thường tan nhiều trong nước.
B. Polymer bị mềm chảy khi đun nóng gọi là polymer nhiệt dẻo.
C. Polymer thường dễ bay hơi.
D. Polymer không có tính đàn hồi.
Câu 9: Để nhận biết các ion Li⁺, Na⁺, K⁺ sử dụng
A. dung dịch CuSO₄.
B. thuốc thử là khí CO₂.
C. ngọn lửa.
D. màu nâu khi đốt.
Câu 10: Phát biểu nào sau đây không giúp hạn chế sự dụng một số loại chất dẻo để giảm thiểu ô nhiễm môi trường?
A. Chất dẻo tái sử dụng các sản phẩm làm từ nhựa.
B. Tăng cường sử dụng túi giấy.
C. Hạn chế sử dụng túi nilon, bao bì nhựa.
D. Tăng sử dụng các túi bột ngô, túi nylon.
Câu 11: Trong phức chất \[Fe(H₂O)₆]³⁺, liên kết giữa nguyên tử trung tâm và phối tử là
A. liên kết cho – nhận.
B. liên kết cộng hoá trị không phân cực.
C. liên kết hydrogen.
D. liên kết ion.
Câu 12: Ở điều kiện thường, kim loại nào trong nhóm IIA phản ứng chậm với nước?
A. Mg.
B. Ba.
C. Sr.
D. Ca.
Câu 13: Cellulose không có tính chất nào sau đây?
A. Bị thủy phân trong môi trường acid.
B. Hòa tan Cu(OH)₂ ở nhiệt độ phòng.
C. Phản ứng với nước Swaayde.
D. Phản ứng với H₂SO₄ đặc, nóng.
Câu 14: Thủy phân chất béo trong môi trường kiềm luôn thu được alcohol có công thức cấu tạo là
A. CH₂OH-CHOH-CH₂OH.
B. C₃H₅(OH)₃.
C. C₂H₅OH.
D. CH₃OH.
Câu 15: Điện phân dung dịch CuSO₄ với 2 điện cực đều làm bằng than thì
A. nồng độ ion Cu²⁺ trong dung dịch không đổi.
B. khí ở cả hai điện cực là khí O₂.
C. không thu được khí ở anot.
D. không có sự thay đổi quá trình điện phân.
Câu 16: Sodium lauryl sulfate là một trong những chất giặt rửa tổng hợp phổ biến có công thức cấu tạo như sau: 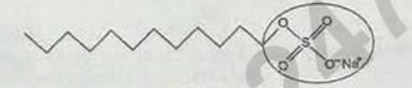 Đặc điểm của nhóm được khoanh tròn trong công thức trên là gì?
Đặc điểm của nhóm được khoanh tròn trong công thức trên là gì?
A. Không phân cực.
B. Tạo kết tủa với nước cứng.
C. Ưa nước.
D. Kị nước.
Câu 17: Ngày 19/3/2025, Cục An toàn thực phẩm (Bộ Y tế) công bố kết quả kiểm nghiệm viên kẹo Kera có chứa 33,4 gam sorbitol/100 gam kẹo. Công dụng của sorbitol là điều trị táo bón và khô miệng; tuy vậy với đối tượng là người lớn hoặc trẻ em, liều dùng thuốc sorbitol sẽ khác nhau; tuy nhiên sorbitol không được xem là thực phẩm như kẹo… (hình ảnh). Số nhóm chức alcohol trong phân tử sorbitol là bao nhiêu?
A. 11
B. 5
C. 6
D. 12
Câu 18: Nhóm tính chất vật lí nào sau đây mà ta có thể đo được bằng công cụ riêng kim loại?
A. Tính dẫn điện.
B. Tính dẻo.
C. Tính đàn hồi.
D. Tính cứng.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) có mỗi câu, thí sinh chọn đúng nhất.
Câu 1. Khi cho carboxylic acid X tác dụng với alcohol Y (H₂SO₄ đặc, đun nóng) thu được este Z có công thức khung phân tử như sau: (hình ảnh)
a) Phản ứng tạo ra Z từ X và Y là phản ứng
b) Carboxylic acid X có thể thu được từ ethyl ethanoate acid.
c) Z có công thức phân tử là C₇H₁₄O₂.
d) Cho 3,00 gam X tác dụng với Y tạo được 3,52 gam Z và thu được 3,90 gam Z thì hiệu suất phản ứng tạo ra Z là
Câu 2. Khi học về tốc độ phản ứng hóa học, một nhóm học sinh đã đưa ra giả thiết sau: “Tốc độ phản ứng tỉ lệ thuận với nồng độ (mol/L) của các chất (ion) tham gia phản ứng với số m lần hệ số tỉ lượng của các chất (ion) đó trong phương trình hóa học”. Để kiểm định giả thiết đó học sinh làm thí nghiệm đo tốc độ phản ứng:
$3I⁻(aq) + S₂O₈²⁻(aq) → I₃⁻(aq) + 2SO₄²⁻(aq)$
với kết quả được ghi lại bảng sau: (hình ảnh)
a) Khi tăng nồng độ chất tham gia phản ứng, tốc độ phản ứng
b) Trong biểu thức tính tốc độ phản ứng là $v = k[I⁻]^m[S₂O₈²⁻]^n$, k là hằng số tốc độ phản ứng phụ thuộc vào nhiệt độ và bản chất phản ứng.
c) Hằng số tốc độ k càng lớn thì ảnh hưởng của nhiệt độ đến phản ứng càng lớn.
d) Với kết quả thí nghiệm trên, nhận định đúng là
Câu 3. Khi nghiên cứu tính chất hóa học của các amine, học sinh Minh cho rằng amine có tính base trong trong dung môi là nước, trong khi Vy lại cho rằng amine có tính base ngay cả khi không có dung môi.
Để chứng minh tính base trong dung dịch, Minh đã làm thí nghiệm sau:
– Bước 1: Lấy 5 mL dung dịch CH₃NH₂ vào ống nghiệm, thêm một ít dung dịch phenolphtalein.
– Bước 2: Thêm tiếp dung dịch HCl vào ống nghiệm đến khi dung dịch trong suốt.
Để chứng minh tính base khi không có dung môi, Vy đã làm thí nghiệm bằng cách cho hơi CH₃NH₂ vào ống nghiệm đựng CH₃COOH đặc, thấy có khói trắng xuất hiện.
a) Ở thí nghiệm của bạn Minh, chỉ cần tối bước 1 cũng chứng minh được CH₃NH₂ có tính base.
b) Khói trắng xuất hiện trong thí nghiệm của bạn Vy có công thức là CH₃NH₃Cl.
c) Thí nghiệm của bạn Vy chứng minh được ngay cả khi không có dung môi CH₃NH₂ cũng có tính base.
Câu 4. Trong quá trình làm thí nghiệm về nhận biết các cation của kim loại nhóm IIA, một học sinh làm các thí nghiệm như sau ở 20°C:
* Thí nghiệm 1: Cho 3 mL dung dịch CaCl₂ vào ống nghiệm, thêm tiếp 2 mL dung dịch NaOH.
* Thí nghiệm 2: Cho 3 mL dung dịch MgCl₂ vào ống nghiệm, thêm tiếp 2 mL dung dịch NaOH.
Trong cả hai thí nghiệm học sinh đều thấy xuất hiện kết tủa trắng. Để giải thích cho hiện tượng trên và nhận biết, học sinh tra cứu độ tan của các chất ở 20°C như sau: (hình ảnh)
| Chất | Ca(OH)₂ | Mg(OH)₂ | NaCl |
| ——————– | ——— | ——— | —— |
| Độ tan (g/100 g H₂O) | 0,173 | 0,00125 | 36 |
a) Kết tủa thu được ở thí nghiệm 1 là Ca(OH)₂.
b) Ở 20°C dung dịch tạo kết tủa nhiều hơn Mg(OH)₂.
c) Ở 20°C dung dịch bão hoà Ca(OH)₂ có khối lượng riêng 1,01 g/mL thì nồng độ Ca(OH)₂ khoảng 0,02357M.
d) Biết rằng ở 20°C trong dung dịch có \[Ca²⁺]\[OH⁻]² > 5,4.10⁻⁶ thì xuất hiện kết tủa. Khi thực hiện thí nghiệm cho 20 mL dung dịch CaCl₂ (nồng độ 0,1M) vào 30 mL dung dịch NaOH 0,1M, ở 20°C thì có xuất hiện kết tủa không?
d) Có vì tích nồng độ ion lớn hơn tích số tan.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Tiến hành xác định thành phần phần trăm khối lượng hợp kim Cu–Zn (Cu chiếm 80% khối lượng). Dùng một đoạn dây hợp kim có khối lượng 10,44 gam làm catot trong bình điện phân chứa dung dịch ZnSO₄ 1M. Cho dòng điện một chiều cường độ 1,25A chạy qua trong 1 giờ thì chỉ có kẽm bám lên catot (giả sử điện phân hoàn toàn).
Biết: Zn²⁺ + 2e → Zn F = 96500 C/mol
Số mol electron trao đổi là:
$n_e = \frac{I \cdot t}{F} = \frac{1,25 \cdot 3600}{96500} ≈ 0,0466 \text{ mol}$
Khối lượng kẽm bám vào catot là:
$m_{\text{Zn}} = 0,0466 \cdot 65 = 3,03 \text{ gam}$
Khối lượng hợp kim ban đầu: 10,44 gam
→ Phần trăm khối lượng Zn trong hợp kim ban đầu là bao nhiêu?
Câu 2. Trong phân tử triolein có x liên kết π và 1 mol triolein phản ứng tối đa với y mol H₂ (Ni, t°). Giá trị x + y bằng bao nhiêu?
Câu 3. Kim loại X thuộc dãy kim loại chuyển tiếp thuộc nhóm VIIIB, có số electron độc thân lớn nhất so với các kim loại trong dãy. Số hiệu nguyên tử của X là bao nhiêu?
Câu 4. Các loại nước uống được đánh số thứ tự và thành phần như sau: (hình ảnh bảng)
Hãy liệt kê theo thứ tự tăng dần những loại đồ uống cho kết quả dương tính (tức là có phản ứng tạo màu tím) với thuốc thử biuret? Ví dụ: 134; 14…
Câu 5. Cho phương trình nhiệt hóa học của phản ứng phân hủy muối calcium carbonate:
$\text{CaCO₃ (s)} → \text{CaO (s)} + \text{CO₂ (g)} \quad ΔH_{\text{phản ứng}} = +179,20 \text{ kJ}$
Nung hoàn toàn 1 tấn đá vôi (có hàm lượng CaCO₃ là 80%, còn lại là tạp chất trơ) bằng nhiệt lượng đốt cháy khí chứa carbon và vật chất khác (than tổ ong, sản phẩm cháy chỉ có CO₂), biết:
$$
ΔH_{\text{cháy}} (\text{CO}) = –393,50 \text{ kJ/mol}
$$
Biết rằng chỉ có 71,68% lượng nhiệt đốt cháy khí sử dụng cho phản ứng nung vôi.
→ Số mol CO₂ đã thải ra trong môi trường trong quá trình trên là bao nhiêu? *(Làm tròn đến hàng đơn vị)
Câu 6. Liên kết đôi C=C bị oxi hóa bằng phản ứng ozone phân hủy tạo ra các sản phẩm hữu cơ chứa oxygen. Nếu thực hiện ozone phân hủy ngay bằng chất khử êm dịu như dimethyl sulfide (CH₃)₂S thì thu được các sản phẩm aldehyde hoặc ketone.
Cho hydrocarbon X mạch hở có công thức phân tử C₉H₁₆ ozone phân hủy theo điều kiện trên thu được 3 chất hữu cơ là CH₃COCH₃, CH₃CH₂CHO và CH₃CH₂CHO.
Cho X tác dụng với Br₂ (CCl₄) thu được chất hữu cơ Y có công thức phân tử C₉H₁₆Br₂. Khi định danh và gọi tên mạch chính để đặt tên Y theo danh pháp IUPAC thì tổng số vị trí nhánh và nhóm thế là bao nhiêu?
Mục đích tổ chức kỳ thi Đại học năm 2025 là gì?
Căn cứ theo quy chế hiện hành của Bộ Giáo dục và Đào tạo và các văn bản hướng dẫn tổ chức kỳ thi Đại học năm 2025, mục đích của kỳ thi là:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo yêu cầu của chương trình giáo dục phổ thông.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục của địa phương và cả nước, làm cơ sở điều chỉnh nội dung, phương pháp dạy học trong nhà trường.
Thí sinh thi Đại học năm 2025 có bắt buộc thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo và hướng dẫn tổ chức kỳ thi tốt nghiệp Đại học năm 2025, thí sinh dự thi phải thực hiện như sau:
– Thi 3 môn bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
– Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp: Khoa học Tự nhiên (gồm các môn Vật lí, Hóa học, Sinh học) hoặc Khoa học Xã hội (gồm các môn Lịch sử, Địa lí, Giáo dục công dân – dành cho học sinh học chương trình giáo dục phổ thông).
Trong số các môn thi, Hóa học là một trong ba môn thuộc bài thi tổ hợp Khoa học Tự nhiên, thí sinh chỉ phải thi môn Hóa học nếu chọn tổ hợp này, không phụ thuộc vào mục đích xét tuyển đại học.
Như vậy, kỳ thi Đại học năm 2025 không bắt buộc thí sinh phải thi môn Hóa học, việc thi môn này phụ thuộc vào lựa chọn bài thi tổ hợp của thí sinh.




