Đề thi thử Đại học 2025 môn Hóa học Trường THPT Tiên Du là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi được xây dựng bám sát theo đề minh họa 2025 của Bộ GD&ĐT, với 40 câu hỏi trắc nghiệm khách quan trải dài toàn bộ chương trình Hóa học 12. Câu hỏi được phân chia theo 4 mức độ: Nhận biết, Thông hiểu, Vận dụng và Vận dụng cao, đảm bảo tính phân hóa và phù hợp với mục tiêu xét tốt nghiệp và xét tuyển đại học. Các chuyên đề trọng tâm xuất hiện trong đề bao gồm: Este – Lipit, Cacbohidrat, Amin – Amino axit – Protein, Polime, Kim loại và hợp chất, phản ứng oxi hóa – khử, điện phân, đồ thị hóa học và câu hỏi thực tiễn.
Đặc biệt, đề thi từ THPT Tiên Du có cách ra đề khá đặc trưng, thường kết hợp giữa kiến thức cơ bản với các tình huống ứng dụng thực tế, giúp học sinh không chỉ rèn kỹ năng giải nhanh mà còn hiểu sâu bản chất hiện tượng hóa học.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 TRƯỜNG THPT TIÊN DU





PHẦN I. CÂU TRẮC NGHIỆM NHIỀU PHƯƠNG ÁN LỰA CHỌN. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: (biết) Trong định nghĩa về liên kết ion: “Liên kết kim loại là liên kết hình thành do lực hút tĩnh điện giữa các electron…(1)… với các ion…(2)… kim loại ở các nút mạng”.
Các từ cần điền vào vị trí (1), (2) là?
A. Ngoại cùng, dương.
B. Tự do, dương.
C. Hóa trị, lượng cực.
D. Hóa trị, âm.
Câu 2: (biết) Biến thiên enthalpy chuẩn (ΔrHo298) của phản ứng XCO3 (s) ⇌ XO (s) + CO2 (g), được cho ở bảng sau:
Dựa vào giá trị ΔrHo298 được cho, nhiệt độ phân hủy thành oxide của các muối carbonate của kim loại nhóm IIA giảm dần theo dãy nào sau đây:
A. MgCO3, CaCO3, SrCO3, BaCO3.
B. BaCO3, SrCO3, CaCO3, MgCO3.
C. BaCO3, CaCO3, SrCO3, MgCO3.
D. MgCO3, BaCO3, SrCO3, CaCO3.
Câu 3: (hiểu) Polymer nào sau đây không dây dẳng khi polymer tổng hợp?
A. Polypropylene.
B. Nylon.
C. Teflon.
D. Carbohydrate.
Câu 4: (biết) Cho biết cấu hình electron của nguyên tử từ các nguyên tố sau:
X: 1s2 Y: 1s22s22p63s2 Z: 1s22s22p63s23p1 T: 1s22s22p3
Nguyên tố kim loại là
A. Y.
B. Z, X.
C. X, Y, T.
D. X, Y.
Câu 5: (hiểu) Điều nào sau đây giải thích đúng nhất về cấu trúc và tính chất của tinh thể ion NaCl?
A. NaCl có cấu trúc lập phương tâm diện, mỗi ion Na+ được bao quanh bởi 8 ion Cl–, tạo nên mạng tinh thể bền vững và giúp muối này có nhiệt độ nóng chảy cao.
B. NaCl có nhiệt độ nóng chảy cao vì lực hút tĩnh điện mạnh giữa các ion Na+ và Cl– trong mạng tinh thể.
C. Cấu hình một lớp tác động đủ lớn, các lớp ion Na+ và Cl– trong tinh thể có thể trượt qua nhau, làm cho các ion cùng dấu nằm gần nhau, gây ra lực đẩy mạnh giữa chúng và khiến tinh thể dễ dàng bị vỡ.
D. NaCl có nhiệt độ sôi thấp do cấu trúc mạng tinh thể lỏng lẻo và dễ vỡ. Khi tan trong nước, các ion Na+ và Cl– giữ nguyên vị trí ban đầu trong mạng tinh thể nhưng tạo thành dung dịch nhờ sự hòa tan một phần.
Câu 6: (hiểu) Ở 20oC, độ tan của Ca(OH)2 trong nước là 0,173g trong 100g nước. Biết khối lượng riêng của dung dịch là 1g/ml, nồng độ mol của dung dịch Ca(OH)2 bão hòa ở nhiệt độ này là bao nhiêu?
A. 1,73 × 10-2 mol/L
B. 2,33 × 10-2 mol/L
C. 0,173 × 10-2 mol/L
D. 3,40 × 10-2 mol/L
Câu 7: (vận dụng) Methyl methacrylate CH2=C(CH3)-COOCH3 trải qua phản ứng trùng hợp trong những điều kiện nhất định để thu được polymer tuyến tính a, sau đó phản ứng với tác nhân liên kết ngang b để tạo thành polymer có cấu trúc mạng lưới được thể hiện trong hình bên dưới.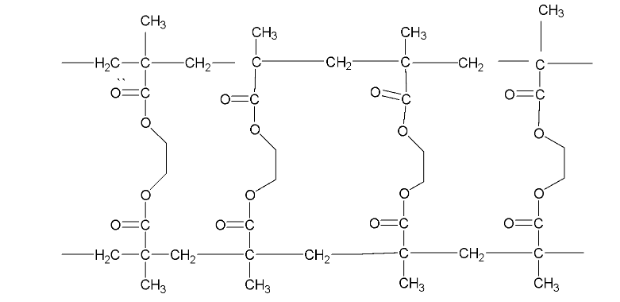
Cho biết: R1COOR2 + R3OH <-> R1COOR3 + R2OH
Phát biểu nào sau đây sai?
A. Phản ứng trùng hợp xảy ra trong quá trình hình thành các polymer mạch không phân nhánh.
B. Polymer không phân nhánh a có thể tạo thành cấu trúc mạng không gian bằng cách hình thành liên kết ngang với ethylene glycol.
C. Trong những điều kiện nhất định, polymer cấu trúc mạng không gian bị thủy phân và tác nhân liên kết ngang b có thể được tái chế và tái sử dụng.
D. Nước được tạo ra trong quá trình liên kết ngang.
Câu 8: (vận dụng) Cho các phát biểu sau:
(1) Dung dịch phèn chua có khả năng làm sạch gỉ trên inox.
(2) Có thể sử dụng bình chữa cháy sắt, nhôm để vận chuyển HNO3 đặc, nguội.
(3) Có thể dùng H2SO4 đặc để làm khô các khí NH3 và NH3.
(4) Trong công nghiệp tổng hợp NH3 theo qui trình Haber, hỗn hợp khí N2 và H2 được đưa vào thiết bị nén để tăng áp suất giúp nâng cao hiệu suất tổng hợp NH3.
Số phát biểu đúng là
A. 2
B. 3
C. 4
D. 1
Câu 9: (hiểu) Để tách curcumin từ củ nghệ Curcuma longa, người ta nghiền nhỏ củ nghệ tươi rồi ngâm trong cồn 90o, đun nóng, sau đó lọc bỏ bã, lấy phần nước lọc, loại bớt dung môi, làm lạnh và để yên một thời gian rồi lọc lấy kết tủa màu vàng là curcumin.
Phát biểu đúng là
A. Quá trình trên đã sử dụng phương pháp chiết và kết tinh.
B. Quá trình trên đã sử dụng phương pháp chiết, chưng cất và kết tinh.
c) Có thể sử dụng phương pháp sắc kí cột để thu curcumin từ dịch chiết.
d) Để tăng độ tinh khiết của curcumin, quá trình làm lạnh nên được thực hiện từ từ nhằm tạo điều kiện cho các tinh thể hình thành và phát triển một cách ổn định hơn.
Câu 10: (biết) Hợp chất CH3[CH2]14COO[CH2]29CH3 có trong sáp ong thuộc loại hợp chất nào sau đây?
A. Ester không no, đơn chức, mạch hở, không phân nhánh.
C. Ester no đơn chức, mạch hở, không phân nhánh.
B. Chất béo.
D. Ester no no don chức, mạch hở, phân nhánh.
Câu 11: (hiểu) Cho các phát biểu sau:
(1) Dùng dịch ethylamine và dung dịch aniline đều làm xanh giấy quỳ tím.
(2) Nhỏ từ từ đến dư dung dịch methylamine vào dung dịch copper(II) sulfate, ban đầu thấy xuất hiện kết tủa màu xanh nhạt, sau đó kết tủa tan tạo thành dung dịch màu xanh lam.
(3) Cho dung dịch dimethylamine vào ống nghiệm đựng dung dịch iron(II) chloride thấy xuất hiện kết tủa nâu đỏ.
(4) Nhỏ vài giọt dung dịch aniline vào ống nghiệm đựng nước bromine thấy xuất hiện kết tủa trắng.
Số phát biểu đúng là
C. 3.
A. 1.
B. 2.
D. 4.
Câu 12: (biết) Công thức Haworth của một carbohydrate X như sau: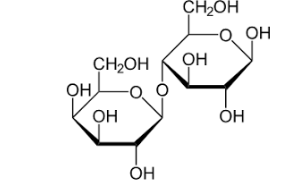
Phát biểu nào sau đây đúng?
A. X là một disaccharide.
C. X có công thức phân tử (C12H10O5)n.
D. Liên kết trong cấu tạo của X là α-1,4-glycoside.
B. X được tạo nên từ 2 gốc β-glucose.
Câu 13: (vận dụng) Trong công nghiệp hiện nay, để hạn chế chất thải ra môi trường và làm tăng hiệu suất của quá trình sản xuất PVC từ ethylene, người ta thực hiện quy trình sản xuất khép kín với phản ứng (1), (2), (3), (4) theo sơ đồ sau: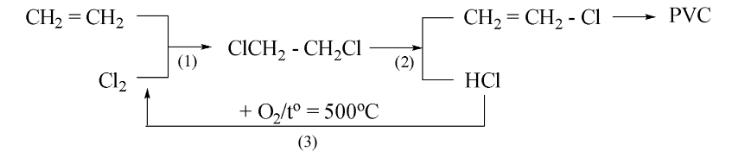
Phát ứng (3) là phản ứng tách nước thực hiện với KOH trong dung môi nước, đun nóng.
b. Phản ứng (3) giúp hạn chế ô nhiễm môi trường và làm tăng hiệu quả của quá trình sản xuất.
c. Đốt cháy là phương pháp xử lí chất thải nhựa PVC không làm ô nhiễm môi trường.
d. Để sản xuất 1 tấn PVC theo chu trình khép kín như sơ đồ trên thì cần 576 kg chlorine biết lượng chlorine bị thất thoát mất 1,4%.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14: (biết) Trong công nghiệp hydrogen hoá chất béo không no thành chất béo no để sản xuất các loại bơ nhân tạo. Chất béo X có công thức phân tử là C55H106O6. Hydrogen hoá hoàn toàn chất béo X (xúc tác Ni, to) thu được chất béo Y. Công thức phân tử của Y là
A. C55H104O6
C. C55H112O6
B. C55H108O6
D. C55H110O6
Câu 15: (biết) Tại pH = 9,6, lysine (pI = 9,74) tồn tại dưới dạng nào sau đây?
A. NH2+-(CH2)4-CH(NH3+)-COO–
D. NH3+-(CH2)4-CH(NH3+)-COO–
C. NH2+-(CH2)4-CH(NH2)-COO–
B. NH2+-(CH2)4-CH(NH2)-COO+
Câu 16: (vận dụng) Tiến hành thí nghiệm với 4 dung dịch X, Y, Z, T đựng trong các lọ riêng biệt, kết quả được ghi trong bảng sau: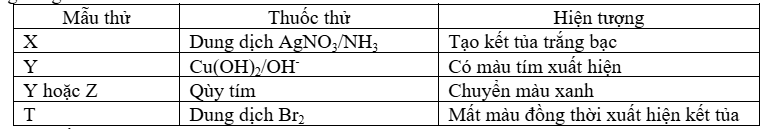
Các chất X, Y, Z, T lần lượt là
A. Glucose, Ala-Lys-Val, aniline, ethylamine.
B. Glucose, Lys-Val-Gly, alanin, aniline.
C. Fructose, Lys-Val-Gly, ethylamine, alanine.
D. Fructose, Gly-Ala-Val, alanin, ethylamine.
Câu 17: (hiểu) Cho thế điện cực chuẩn của các cặp oxi hóa – khử sau:
EoMnO4–/Mn2+ = +1,51 V; EoFe3+/Fe2+ = +0,77 V.
Phát biểu nào sau đây sai?
A. MnO4– có tính oxi hóa mạnh hơn Fe3+.
B. Ion Fe2+ có thể bị oxi hóa bởi ion MnO4–.
C. Khi cho Fe(NO3)2 vào dung dịch KMnO4, quá trình oxi hóa xảy ra là: Fe3+(aq) + 1e → Fe2+(aq) .
D. Ion MnO4– có khả năng oxi hóa ion Fe2+ trong dung dịch thành ion Fe3+.
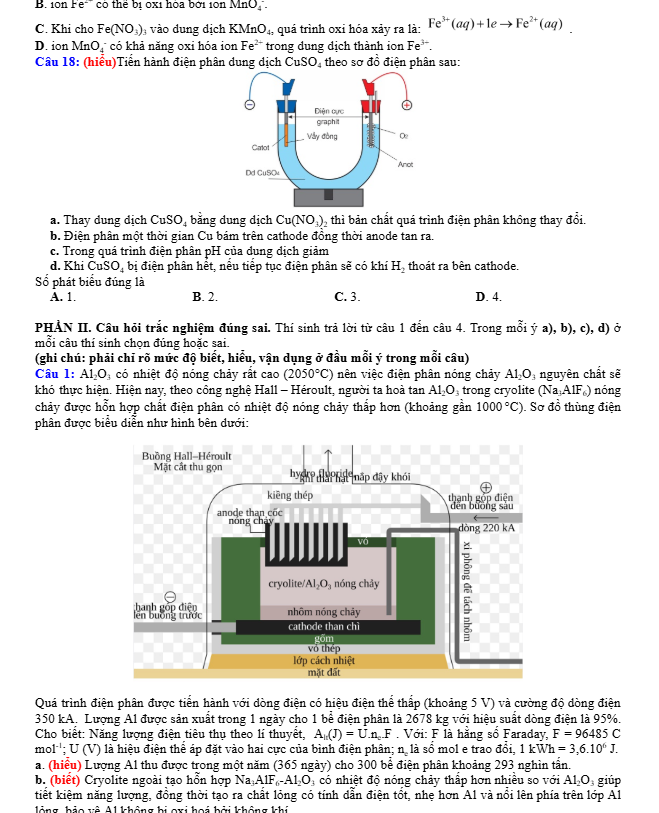
Câu 18: (hiểu) Tiến hành điện phân dung dịch CuSO4 theo sơ đồ điện phân sau: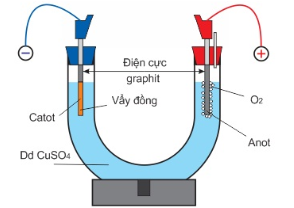
a. Thay dung dịch CuSO4 bằng dung dịch Cu(NO3)2 thì bản chất quá trình điện phân không thay đổi.
B. Điện phân một thời gian Cu bám trên cathode đồng thời anode tan ra.
c. Trong quá trình điện phân pH của dung dịch giảm
d. Khi CuSO4 bị điện phân hết, nếu tiếp tục điện phân sẽ có khí H2 thoát ra cathode.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
PHẦN II. CÂU HỎI TRẮC NGHIỆM ĐÚNG SAI. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
(ghi chú: phải chỉ rõ mức độ biết, hiểu, vận dụng ở đầu mỗi ý trong mỗi câu)
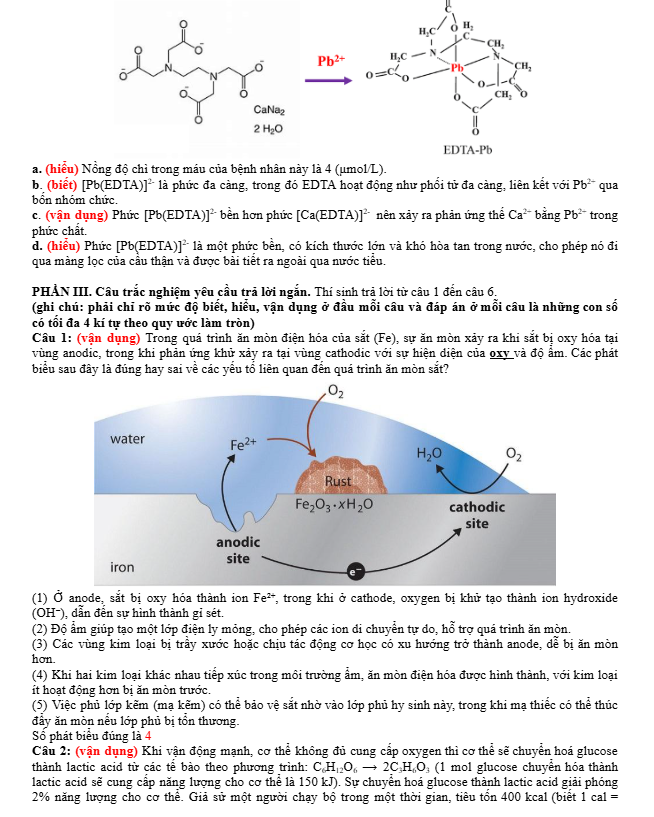
Câu 1: (Câu 1: (vận dụng) Al2O3 có nhiệt độ nóng chảy rất cao (2050oC) nên việc điện phân nóng chảy Al2O3 nguyên chất sẽ khó thực hiện. Hiện nay, theo công nghệ Hall – Héroult, người ta hoà tan Al2O3 trong cryolite (Na3AlF6) nóng chảy được hỗn hợp chất điện phân có nhiệt độ nóng chảy thấp hơn (khoảng gần 1000oC). Sơ đồ thùng điện phân được biểu diễn như hình bên dưới: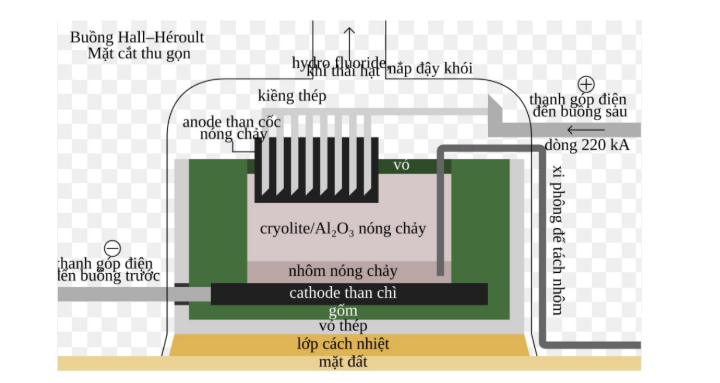
Quá trình điện phân được tiến hành với dòng điện có hiệu điện thế thấp (khoảng 5 V) và cường độ dòng điện 350 kA. Lượng Al được sản xuất trong 1 ngày cho 1 bể điện phân là 2678 kg với hiệu suất dòng điện là 95%. Cho biết: Năng lượng điện tiêu thụ theo lí thuyết, ALT(J) = U.ne.F . Với: F là hằng số Faraday, F = 96485 C mol-1; U (V) là hiệu điện thế áp đặt vào hai cực của bình điện phân; ne là số mol e trao đổi. 1 kWh = 3,6.106 J.
a. (hiểu) Lượng Al thu được trong một năm (365 ngày) cho 300 bể điện phân khoảng 293 nghìn tấn.
b. (biết) Cryolite ngoài tạo hỗn hợp Na3AlF6-Al2O3 có nhiệt độ nóng chảy thấp hơn nhiều so với Al2O3 giúp tiết kiệm năng lượng, đồng thời tạo ra chất lỏng có tính dẫn điện tốt, nhẹ hơn Al và nổi lên phía trên lớp Al lỏng, bảo vệ Al không bị oxi hoá bởi không khí.
c. (vận dụng) Năng lượng điện tiêu thụ để sản xuất được 1 kg Al khoảng 15 kWh (làm tròn đến số nguyên gần nhất).
d. (hiểu) Để sản xuất được 1 tấn Al cần tiêu tốn khoảng 2 tấn Al2O3, 50 kg cryolite, 400 kg than cốc. Lượng Al2O3 tiêu thụ thực tế cao hơn so với lý thuyết do tạp chất trong Al2O3 và thất thoát trong quá trình vận chuyển và xử lý.
Câu 2: Câu 2: (vận dụng) Sản xuất đường kính từ cây mía qua một số giai đoạn chính thể hiện ở sơ đồ dưới đây: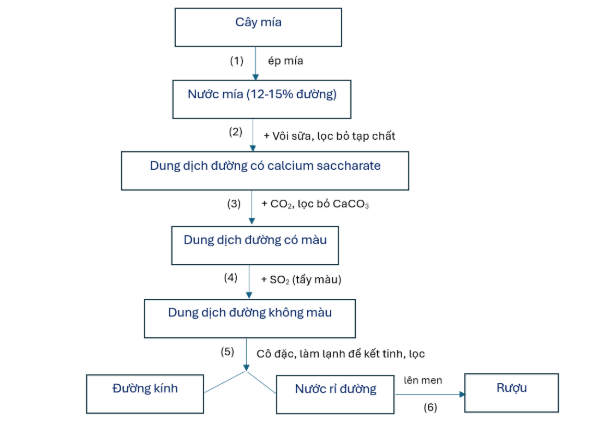
a. (hiểu) Phương pháp sử dụng để tinh chế đường từ cây mía là chiết lỏng-rắn và kết tinh.
b. (hiểu) Có calcium gluconate trong dung dịch đường thu được sau bước (2).
c. (vận dụng) Quá trình cô đặc ở giai đoạn (5) được thực hiện bằng cách cô cạn dung môi ở áp suất thường để thu được đường kết tinh.
d. (hiểu) Từ 260 L nước mía có nồng độ đường 7,5% (có khối lượng riêng 1,103 gam/ml) chế biến được 15,36 kg đường kết tinh (chứa 2% tạp chất). Biết chỉ 70% lượng đường thu được ở dạng kết tinh.
Câu 3: Cho 30 mLdung dịch HNO3 đặc và 25 mLdung dịch H2SO4 đặc vào bình cầu ba cổ lặp ống sinh hàn, phễu nhỏ giọt và nhiệt kế rồi làm lạnh hỗn hợp đến 30oC. Cho từng giọt benzene vào hỗn hợp phản ứng, đồng thời lắc đều và giữ nhiệt độ ở 60oC trong 1 giờ. Để nguội bình, sau đó rót hỗn hợp phản ứng vào phễu chiết, hỗn hợp tách thành hai lớp. Tách bỏ phần acid ở bên dưới. Rửa phần chất lỏng còn lại bằng dung dịch sodium carbonate, sau đó rửa bằng nước, thu được chất lỏng nặng hơn nước, có màu vàng nhạt.
a. (vận dụng) Nhiệt độ phản ứng cần thực hiện ở 50-60 oC để sản phẩm thu được chủ yếu là nitrobenzene.
b. (hiểu) Nitric acid đóng vai trò là chất oxi hoá, sulfuric acid có vai trò chất xúc tác.
c. (biết) Đá xà ra phản ứng thế vào vòng benzene.
d. (hiểu) Phương pháp tách biệt và tinh chế được sử dụng trong thí nghiệm trên là chiết lỏng-lỏng và kết tinh.
Câu 4. Nhiễm độc chì luôn đáng lo ngại. Trong cơ thể con người, mức độ độc hại của chì có thể được giảm bớt bằng cách sử dụng phối tử EDTA4- để tạo phức [Pb(EDTA)]2- rất bền (hằng số bền β(Pb) = 1018,0) và được thận bài tiết. Phối tử EDTA4- được cung cấp bằng cách tiêm truyền dung dịch Na2[Ca(EDTA)]. Biết phức [Ca(EDTA)]2- tương đối kém bền (hằng số bền β(Ca) = 1010,7), sự trao đổi calcium với chì chủ yếu diễn ra trong mạch máu. Hàm lượng chì trong máu của một bệnh nhân là 0,828 μg/mL.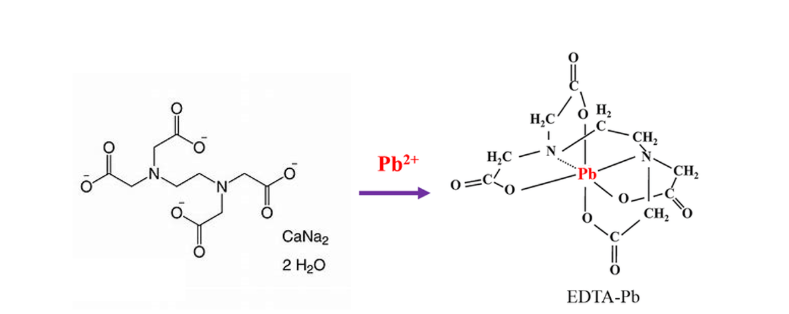
a. (hiểu) Nồng độ chì trong máu của bệnh nhân này là 4 (μmol/L).
b. (biết) [Pb(EDTA)]2- là phức đa càng, trong đó EDTA hoạt động như phối tử đa càng, liên kết với Pb2+ qua bốn nhóm chức.
c. (vận dụng) Phức [Pb(EDTA)]2- bền hơn phức [Ca(EDTA)]2- nên xảy ra phản ứng thế Ca2+ bằng Pb2+ trong phức chất.
d. (hiểu) Phức [Pb(EDTA)]2- là một phức bền, có kích thước lớn và khó hòa tan trong nước, cho phép nó đi qua màng lọc của cầu thận và được bài tiết ra ngoài qua nước tiểu.
PHẦN III. CÂU TRẮC NGHIỆM TRẢ LỜI NGẮN. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: (vận dụng) Trong quá trình ăn mòn điện hóa của sắt (Fe), sự ăn mòn xảy ra khi sắt bị oxy hóa tại vùng anodic, trong khi phản ứng khử xảy ra tại vùng cathodic với sự hiện diện của oxy và độ ẩm. Các phát biểu sau đây là đúng hay sai về các yếu tố liên quan đến quá trình ăn mòn sắt?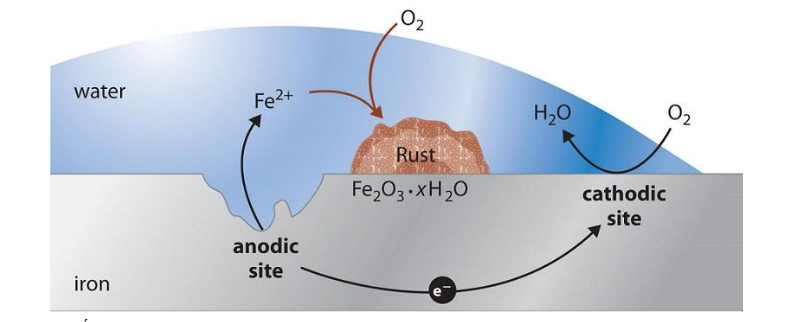
(1) Ở anode, sắt bị oxy hóa thành ion Fe2+, trong khi ở cathode, oxygen bị khử tạo thành ion hydroxide (OH–), dẫn đến sự hình thành gỉ sét.
(2) Độ ẩm giúp tạo một lớp điện ly mỏng, cho phép các ion di chuyển tự do, hỗ trợ quá trình ăn mòn.
(3) Các vùng kim loại bị trầy xước hoặc chịu tác động cơ học có xu hướng trở thành anode, dễ bị ăn mòn hơn.
(4) Khi hai kim loại khác nhau tiếp xúc trong môi trường ẩm, ăn mòn điện hóa được hình thành, với kim loại ít hoạt động hơn bị ăn mòn trước.
(5) Việc phủ lớp kẽm (mạ kẽm) có thể bảo vệ sắt nhờ vào lớp phủ hy sinh này, trong khi mạ thiếc có thể thúc đẩy ăn mòn nếu lớp phủ bị tổn thương.
Số phát biểu đúng là ______.
Câu 2: (vận dụng) Khi vận động mạnh, cơ thể không đủ cung cấp oxygen thì cơ thể sẽ chuyển hoá glucose thành lactic acid từ các tế bào để cung cấp năng lượng cho cơ thể theo phương trình: C6H12O6 → 2C3H6O3 (1 mol glucose chuyển hóa thành lactic acid sẽ cung cấp năng lượng cho cơ thể là 150 kJ). Sự chuyển hoá glucose thành lactic acid giải phóng 2% năng lượng cho cơ thể. Giả sử một người chạy bộ trong một thời gian, tiêu tốn 400 kcal (1 cal = 4,184J). Khối lượng lactic acid được chuyển hóa bằng bao nhiêu gam? (Kết quả làm tròn đến hàng phần mười) ______.
Câu 3: (hiểu) Cellobiose là carbohydrate thu được từ quá trình thủy phân một số vật liệu chứa cellulose như bông, đay với xúc tác enzyme. Cellobiose có công thức như sau: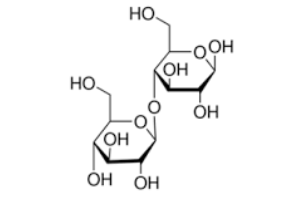
Phân tử khối của cellobiose là bao nhiêu? ______.
Câu 4: (hiểu) Alanine phản ứng với ethyl alcohol khi có mặt HCl khan theo sơ đồ sau:![]()
(1) Trong phản ứng trên, nhóm –OH của –COOH (Ala) được thay thế bởi –OC2H5. Phản ứng này là phản ứng riêng nhóm –COOH.
(2) Thu được có công thức là H2NCH(CH3)COOC2H5.
(3) Phần trăm khối lượngnguyên tố nitrogen trong X là 8,16%.
(4) 1 mol X tác dụng tối đa được với 2 mol NaOH thu được Ala.
Liệt kê các phát biểu sai theo số thứ tự tăng dần. ______.
Câu 5: (vận dụng) Calcium trong máu hoặc nước tiểu có thể được xác định bằng kết tủa dưới dạng calcium oxalate (CaC2O4). Hòa tan kết tủa trắng acid mạnh và chuẩn độ bằng dung dịch KMnO4. Phương trình phản ứng là: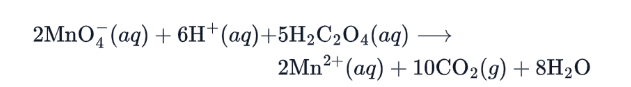
Mẫu nước tiểu 24 giờ được thu thập từ một bệnh nhân người lớn, một lượng nhỏ thể tích được trích ra và chuẩn độ vừa đủ với 26,2 mL KMnO4 0,0946 M. Ngưỡng cho phép về hàm lượng Ca2+ trong máu lượng cho một người lớn là 100 đến 300 mg mỗi 24 giờ. Hàm lượng Ca2+ (mg) trong máu của người lớn này là bao nhiêu? (Làm tròn đến số nguyên gần nhất. ______.
Câu 6: (vận dụng) Một nhà máy mẫu xác định độ cứng tổng và nồng độ ion Ca2+ của mẫu nước khoáng. Trong Phần A, kỹ sư chuẩn độ 50 cm3 nước khoáng với ethylenediaminetetraacetic acid (EDTA) 0,01 M, mất 18,5 mL EDTA để chuyển màu đỏ rượu sang xanh da trời. Trong Phần B, kỹ sư thêm NaOH để loại Mg2+, sau đó chuẩn độ 50 cm3 nước khoáng với EDTA 0,01 M, mất 12,4 mL để chuyển sang màu xanh da trời. Hãy tính Nồng độ Mg2+ (ppm) trong nước. Biết ppm số mg chất tan trong 1 L dung dịch và phương trình chuẩn độ như sau: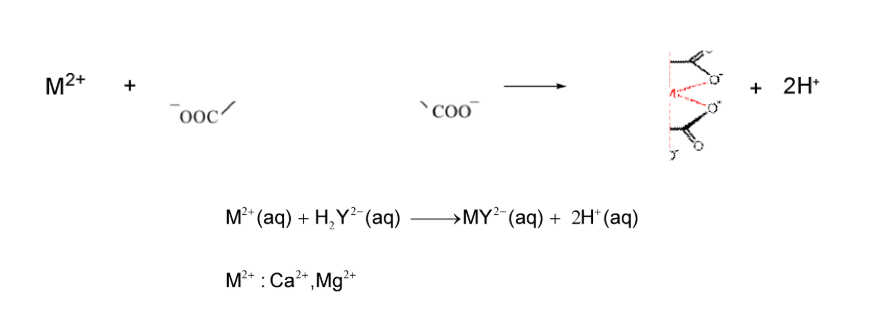
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các cơ sở giáo dục đại học, cao đẳng tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên cả nước, làm cơ sở để điều chỉnh nội dung, phương pháp dạy học trong các nhà trường.
Thí sinh thi Tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo, thí sinh dự thi Tốt nghiệp THPT năm 2025 phải tham gia 3 bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh lựa chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí, Giáo dục công dân (đối với học sinh chương trình GDPT).
Trong bài thi tổ hợp KHTN, môn Hóa học là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học, trừ khi chọn bài thi tổ hợp KHTN để xét tốt nghiệp hoặc phục vụ mục tiêu xét tuyển đại học, cao đẳng vào các ngành có yêu cầu môn Hóa học.
Vì vậy, Đề thi thử tốt nghiệp THPT 2025 môn Hóa học do Trường THPT Tiên Du biên soạn là tài liệu ôn tập hữu ích dành cho các thí sinh chọn tổ hợp KHTN. Đề giúp học sinh hệ thống lại kiến thức, luyện tập kỹ năng làm bài trắc nghiệm, đồng thời đánh giá năng lực bản thân để chuẩn bị tốt cho kỳ thi chính thức.




