Đề thi thử Đại học 2025 môn Hóa học Trường THPT Yên Phong là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi thử tốt nghiệp THPT 2025 môn Hóa học Trường THPT Yên Phong được thiết kế dựa trên cấu trúc đề minh họa chính thức từ Bộ GD&ĐT, với mục tiêu giúp học sinh lớp 12 rèn luyện năng lực toàn diện trước kỳ thi tốt nghiệp. Nội dung đề bao phủ đầy đủ các chuyên đề trọng tâm của chương trình Hóa học lớp 12 như: điện phân, phản ứng oxi hóa – khử, kim loại – phi kim, este – lipit, amin – amino axit – peptit – protein, hóa học hữu cơ tổng hợp, bài toán đồ thị, và các câu hỏi ứng dụng thực tiễn.
Đề thi có mức độ câu hỏi được sắp xếp logic, từ dễ đến khó, giúp học sinh làm quen với áp lực thời gian và phân bố thời lượng hợp lý trong phòng thi. Các câu hỏi vận dụng cao được lồng ghép khéo léo nhằm đánh giá tư duy phân tích, tổng hợp kiến thức – một kỹ năng không thể thiếu để đạt điểm số cao trong kỳ thi chính thức.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 5 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐẠI HỌC MÔN HÓA HỌC NĂM 2025 TRƯỜNG THPT YÊN PHONG





PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Thành phần chính của muối ăn là
A. CaCO₃.
B. Mg(NO₃)₂.
C. BaCl₂.
D. NaCl.
Câu 2: Kim loại tungsten (W) được dùng làm dây tóc bóng đèn sợi đốt. Ứng dụng này dựa trên tính chất nào của kim loại W?
A. Nhiệt độ nóng chảy cao.
B. Khối lượng riêng lớn.
C. Độ cứng cao.
D. Tính dẻo cao.
Câu 3: Ethene phản ứng với bromine trong dung dịch theo phương trình hóa học sau:
CH₂=CH₂ + Br₂ → BrCH₂–CH₂Br
Phản ứng trên thuộc loại
A. phản ứng tách.
B. phản ứng acid-base.
C. phản ứng thế.
D. phản ứng cộng.
Câu 4: Cho bảng giá trị thế điện cực chuẩn của các cặp oxi hóa – khử như sau: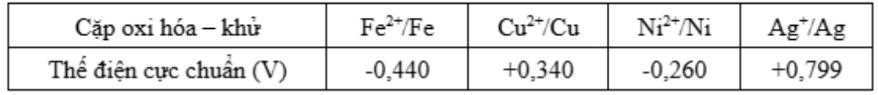 Ở điều kiện chuẩn kim loại nào sau đây có tính khử yếu nhất?
Ở điều kiện chuẩn kim loại nào sau đây có tính khử yếu nhất?
A. Fe.
B. Cu.
C. Ag.
D. Ni.
Câu 5: Nhận định nào sau đây về pin nhiên liệu không đúng?
A. Một trong những hạn chế của pin nhiên liệu là sự lưu trữ nhiên liệu.
B. Pin nhiên liệu biến đổi năng lượng hoá học thành điện năng.
C. Chất oxi hoá thường dùng trong pin nhiên liệu là oxygen.
D. Pin nhiên liệu có cấu tạo đơn giản nên giá thành pin nhiên liệu thấp.
Câu 6: Cho công thức cấu tạo thu gọn của glucose (dạng mạch hở): HOCH₂[CHOH]₄CHO. Ở dạng mạch hở, glucose có số nhóm chức -OH là
A. 5.
B. 4.
C. 3.
D. 6.
Câu 7: Tiến hành thí nghiệm theo các bước sau:
Bước 1: Cho vài giọt dung dịch iodine vào ống nghiệm đựng sẵn 2 mL dung dịch hồ tinh bột 2%, quan sát và ghi nhận hiện tượng trong vài phút ở nhiệt độ thường.
Bước 2: Đun nóng nhẹ dung dịch trên ngọn lửa đèn cồn khoảng 2 phút.
Bước 3: Để dung dịch nguội dần ở nhiệt độ thường, ghi nhận hiện tượng quan sát được.
Cho các phát biểu sau:
(a) Sau bước 1, thu được dung dịch có màu xanh tím.
(b) Sau bước 2, dung dịch trong ống nghiệm mất màu xanh tím.
(c) Sau bước 3, ống nghiệm lại xuất hiện màu xanh tím.
(d) Từ kết quả của thí nghiệm trên, có thể dùng iodine để nhận biết hồ tinh bột.
Số phát biểu đúng là
A. 2.
B. 4.
C. 1.
D. 3.
Câu 8: Điểm chớp cháy được áp dụng trong các quy định an toàn về vận chuyển. Cục Hàng không Việt Nam đã có quy định: Tinh dầu là hàng hóa nguy hiểm nếu có điểm chớp cháy nhỏ hơn 60°C. Quan sát bảng số liệu sau: Theo quy định trên loại tinh dầu mà các hãng hàng không, cho phép vận chuyển là
Theo quy định trên loại tinh dầu mà các hãng hàng không, cho phép vận chuyển là
A. thân cây đinh hương.
B. cam.
C. trà.
D. nhựa thông.
Câu 9: Cho phương trình nhiệt hoá học của phản ứng tổng hợp NH₃ như sau:
3H₂(g) + N₂(g) → 2NH₃(g) ∆rH⁰₂⁹⁸ = a (kJ)
Cho biết năng lượng liên kết của một số liên kết hóa học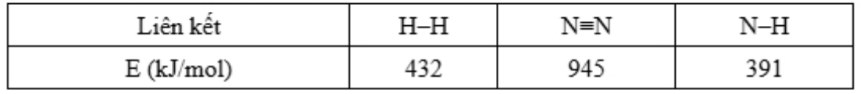 Giá trị của a là
Giá trị của a là
A. -1459.
B. +105.
C. -105.
D. +1459.
Câu 10: Cho các phát biểu sau:
(a) Dung dịch methylamine làm quỳ tím chuyển sang màu đỏ.
(b) Ester ethyl acetate ít tan trong nước.
(c) Tơ nylon-6,6 thuộc loại tơ tự nhiên.
(d) Trong y học glucose được dùng làm thuốc tăng lực (huyết thanh glucose) cho người bệnh.
Số phát biểu đúng là
A. 2.
B. 1.
C. 3.
D. 4.
Câu 11: Linoleic acid (có cấu tạo như hình dưới) là một trong những acid béo có lợi cho sức khỏe tim mạch ngăn ngừa các bệnh về tim, động mạch vành. Nhận xét nào sau đây đúng về linoleic acid?
Nhận xét nào sau đây đúng về linoleic acid?
A. Công thức phân tử của linoleic acid là C₁₈H₃₄O₂.
B. Trong phân tử linoleic acid có hai liên kết π.
C. Linoleic acid có 18 nguyên tử cacbon trong phân tử.
D. Linoleic acid thuộc loại omega-3.
Câu 12: Glutamic acid có các dạng tồn tại và giá trị pH mà dạng tồn tại đó là chủ yếu (≈ 100%) như sau: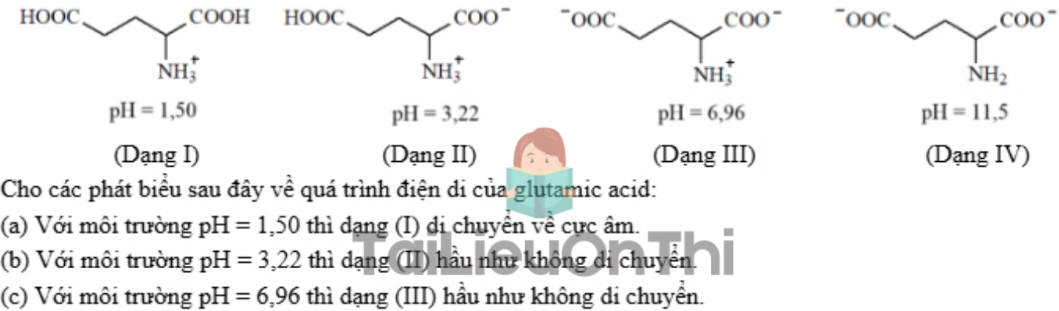
![]()
Số phát biểu đúng là
A. 2.
B. 1.
C. 4.
D. 3.
Câu 13: Thí nghiệm nào xảy ra phản ứng hóa học?
A. Nhúng thanh Ag vào dung dịch Cu(NO₃)₂.
B. Nhúng thanh Cu vào dung dịch FeSO₄.
C. Cho vụn Cu vào dung dịch HCl.
D. Cho bột Cu vào dung dịch Fe₂(SO₄)₃.
Câu 14: Một chai rượu gạo có thể tích 450 mL và có độ rượu là 40⁰. Số mL ethanol nguyên chất (khan) có trong chai rượu đó là
A. 450 mL.
B. 180 mL.
C. 90 mL.
D. 270 mL.
Câu 15: Dung dịch chất nào sau đây làm quỳ tím chuyển sang màu xanh?
A. NaCl.
B. C₂H₅OH.
C. KOH.
D. H₂SO₄.
Câu 16: “Các …(1)… của cùng một nguyên tố hóa học có số …(2)… khác nhau là đồng vị của nhau”. Nội dung phù hợp trong các ô trống (1), (2) lần lượt là
A. nguyên tử, proton.
B. nguyên tố, neutron.
C. nguyên tố, proton.
D. nguyên tử, neutron.
Câu 17: Hemoglobin là thành phần cấu tạo nên hồng cầu trong các mạch máu. Mỗi phân tử hemoglobin chứa x heme B. Mỗi heme B là phức chất với nguyên tử trung tâm là sắt (iron). Heme B kết hợp thêm một phân tử oxygen thông qua đường hô hấp để vận chuyển dưỡng khí đến mô. Mỗi lần đến mô, một phân tử hemoglobin có thể đem đến cho mô tối đa 8 nguyên tử oxygen. Giá trị của x là.
A. 4.
B. 2.
C. 8.
D. 16.
Câu 18: Trong xà phòng có chứa chủ yếu chất nào sau đây?
A. CH₃[CH₂]₁₆COONa.
B. C₃H₅(OH)₃.
C. CH₃[CH₂]₁₆CH₂C₆H₄SO₃Na.
D. CH₃[CH₂]₁₀CH₂OSO₃Na.
PHẦN II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 19 đến câu 22. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 19: Một nhóm học sinh muốn mạ đồng (copper) cho chiếc chìa khóa làm từ thép (hợp kim Fe – C) bằng phương pháp điện phân. Nhóm học sinh đã lấy một đồng xu bằng hợp kim Cu – Zn chứa khoảng 95% đồng về khối lượng.
Cân để xác định khối lượng ban đầu của chìa khóa (35,12 gam) và đồng xu (5,30 gam).
Nối chìa khóa với một điện cực và đồng xu với điện cực còn lại của nguồn điện một chiều, rồi nhúng trong dung dịch copper (II) sulfate.
Điện phân ở hiệu điện thế phù hợp.
Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của chìa khóa và đồng xu, thấy khối lượng chìa khóa là 36,72 gam và khối lượng đồng xu là m₁ gam.
a) Ở cực dương xảy ra quá trình oxi hóa.
b) Trong quá trình thí nghiệm mạ đồng cho chiếc chìa khóa, khối lượng chất tan trong dung dịch điện phân không thay đổi.
c) Giá trị của m₁ lớn hơn 5,30.
d) Thí nghiệm trên, chìa khóa được nối với cực âm, đồng xu được nối với cực dương của nguồn điện.
Câu 20: Khi thuỷ phân hoàn toàn 500 mg một protein, chỉ thu được các amino acid với khối lượng như sau: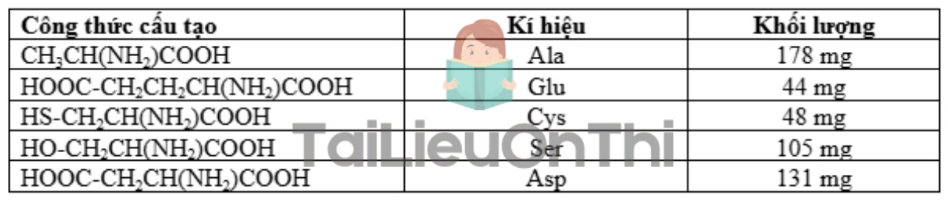

a) Có thể dựa vào tỉ lệ số mol Ala : Ser trong bảng trên để tách riêng từng amino acid trong bảng kết quả trên.
b) Tỉ lệ số mol Ala : Ser trong bảng trên tương ứng là 1 : 2.
c) Nếu phân tử khối của protein này là 50000 thì số mắt xích trong 1 phân tử protein ở trên là 200 Ala; 30 Glu; 40 Cys; 100 Ser; 100 Asp; 40 Val và 20 Lys (làm tròn kết quả đến hàng đơn vị).
d) Trong các amino acid ở trên, lysine (Lys) là một trong những amino acid đóng vai trò quan trọng cho quá trình xây dựng và tạo ra các mạch máu mới trong cơ thể; ở pH = 2, lysine tồn tại dạng cation.
[Hình ảnh cấu trúc hóa học của Sucrose]
Câu 21: X là một disaccharide có công thức cấu tạo sau: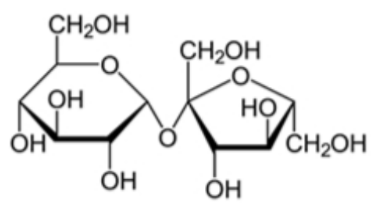 a) Dung dịch của X có phản ứng với thuốc thử Tollens.
a) Dung dịch của X có phản ứng với thuốc thử Tollens.
b) Phần trăm khối lượng của oxygen trong X là 42,11% (làm tròn kết quả đến hàng phần trăm).
c) Thủy phân hỗn hợp gồm 0,02 mol chất X và 0,01 mol maltose trong môi trường acid, với hiệu suất đều là 60% theo mỗi chất, thu được dung dịch A. Trung hòa dung dịch A thu được dung dịch B, sau đó cho toàn bộ B tác dụng hoàn toàn với lượng dư dung dịch AgNO₃ trong NH₃, thu được m gam Ag. Giá trị của m là 8,64.
d) Trong phân tử X có chứa liên kết α-1,2-glycoside.
Câu 22: Aspirin được sử dụng làm thuốc giảm đau, hạ sốt. Sau khi uống, aspirin bị thủy phân trong cơ thể (môi trường acid) tạo thành chất X (hợp chất hữu cơ tạp chức). Chất X ức chế quá trình sinh tổng hợp protaglandin (chất gây đau, sốt và viêm khi nồng độ trong máu cao hơn bình thường). Aspirin có công thức cấu tạo như sau :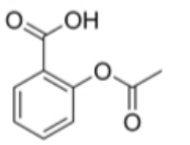 a) Mỗi viên thuốc nén chứa 500 mg aspirin. Để sản xuất 100 000 viên nén từ nguyên liệu ban đầu là chất X với hiệu suất của cả quá trình là 80% thì khối lượng của X cần dùng là 47,92 kg (chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng phần trăm).
a) Mỗi viên thuốc nén chứa 500 mg aspirin. Để sản xuất 100 000 viên nén từ nguyên liệu ban đầu là chất X với hiệu suất của cả quá trình là 80% thì khối lượng của X cần dùng là 47,92 kg (chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng phần trăm).
b) X là acetic acid.
c) Aspirin được điều chế từ carboxylic acid và alcohol tương ứng.
d) Công thức phân tử của aspirin là C₉H₈O₄.
PHẦN III. Câu trắc nghiệm trả lời ngắn. Thí sinh trả lời từ câu 23 đến câu 28.
Câu 23: Tiến hành sản xuất 1 triệu chai rượu vang 13,8⁰ dung tích 750 mL bằng phương pháp lên men rượu với nguyên liệu là m tấn quả nho tươi (chứa 15% glucose về khối lượng). Biết khối lượng riêng của ethyl alcohol là 0,8 g/mL. Giả thiết trong thành phần quả nho tươi chỉ có glucose bị lên men rượu; hiệu suất toàn bộ quá trình sản xuất là 60%. Tính m. (chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị).
Câu 24: Xà phòng, chất giặt rửa được sử dụng rộng rãi trong đời sống: rửa tay, giặt quần áo, rửa chén bát, lau sàn,… Sơ đồ dưới đây mô tả cơ chế giặt rửa của xà phòng và các chất giặt rửa :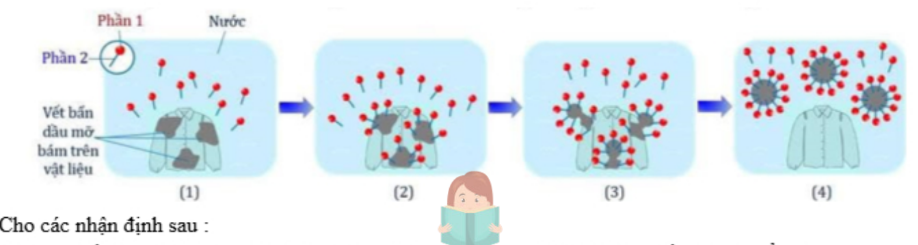 (1) Các chất CH₃[CH₂]₁₀CH₂-C₆H₄-SO₃Na và CH₃[CH₂]₁₀CH₂OSO₃Na là chất giặt rửa tổng hợp.
(1) Các chất CH₃[CH₂]₁₀CH₂-C₆H₄-SO₃Na và CH₃[CH₂]₁₀CH₂OSO₃Na là chất giặt rửa tổng hợp.
(2) Cấu tạo chung của xà phòng và chất giặt rửa gồm một phân tử ưa nước nối với một phần kị nước; trong đó phần ưa nước là các gốc hydrocarbon mạch dài tan nhiều trong nước.
(3) Khi xà phòng tan vào nước phần kị nước trong xà phòng thâm nhập vào vết bẩn, phần chia vết bẩn thành những hạt rất nhỏ; phần ưa nước quay ra ngoài, mang theo các vết bẩn phân tán vào nước và bị rửa trôi.
(4) Xà phòng bị giảm hoặc mất tác dụng giặt rửa khi dùng với nước cứng vì tạo kết tủa với cation Ca²⁺, Mg²⁺.
(5) Từ dầu mỏ, có thể sản xuất được xà phòng và chất giặt rửa tổng hợp.
(6) Chất giặt rửa tổng hợp dễ bị các vi sinh vật phân hủy nên thân thiện với môi trường.
Các nhận định đúng gồm những nhận định nào? (Liệt kê theo thứ tự từ nhỏ đến lớn, ví dụ 123; 234;..).
Câu 25: Cho các loại polymer sau: Polyethylene; polyacrylonitrile; polychloroprene; poly(vinyl chloride); poly(urea-formaldehyde); polypropylene; poly(phenol formaldehyde); polystyrene. Có bao nhiêu polymer dùng để làm chất dẻo ? (làm tròn kết quả đến hàng phần chục).
Câu 26: Phần trăm khối lượng của nguyên tố nitrogen trong glycine là a%. Giá trị của a là bao nhiêu ? (làm tròn kết quả đến hàng phần chục).
Câu 27: Nhôm, titanium và một vài kim loại khác được tạo màu hoặc tăng độ dày của lớp oxide bền ngoài bề mặt bởi phương pháp anodizing (anode hóa), khi đó phần kim loại được xử lý sẽ là điện cực anode của thiết bị điện phân, bị oxi hóa tạo thành lớp màng oxide và kết hợp các phân tử thuốc nhuộm để tạo màu sắc rực rỡ. Để tạo lớp màng aluminium oxide dày 0,01 mm trên bề mặt vật liệu nhôm có tổng diện tích bề mặt là 150 cm² cần thực hiện quá trình điện phân ở trên với dòng điện có cường độ là 0,6A trong thời gian t (phút). Biết điện lượng q = I.t = ne.F; hằng số F = 96485 C/mol, hiệu suất điện phân đạt 96%; khối lượng riêng của Al₂O₃ là 3,97 g/cm³. Xác định giá trị của t. (chỉ làm tròn ở phép tính cuối cùng, làm tròn kết quả đến hàng đơn vị)
Câu 28: Thực hiện các thí nghiệm được đánh số thứ tự như sau :
(1) Thêm vài giọt HNO₃ đặc vào ống nghiệm chứa 2 mL dung dịch lòng trắng trứng.
(2) Cho vài giọt dung dịch aniline loãng vào ống nghiệm chứa nước bromine.
(3) Nhỏ vào giọt dung dịch iodine trong KI vào ống nghiệm chứa 2 mL dung dịch hồ tinh bột.
(4) Cho 2 mL dung dịch NaOH 10% vào ống nghiệm, thêm 0,5 mL dung dịch CuSO₄ 5% vào, lắc nhẹ. Thêm tiếp 3 mL dung dịch glucose 2% vào và lắc đều.
(5) Cho 1 mL dung dịch NaOH 30% vào ống nghiệm, thêm vài giọt dung dịch CuSO₄ 5% vào, lắc nhẹ. Thêm tiếp 3 mL dung dịch lòng trắng trứng vào và lắc đều.
(6) Đưa bình chứa hỗn hợp chlorine và benzene ra ngoài ánh nắng.
Gán số thứ tự của thí nghiệm trên lần lượt theo các hiện tượng của phản ứng: a) dung dịch màu xanh lam; b) chất rắn màu vàng; c) khói trắng và chất bột trắng; d) dung dịch màu tím.
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các cơ sở giáo dục đại học, cao đẳng tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên cả nước, làm cơ sở để điều chỉnh nội dung, phương pháp dạy học trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 phải tham gia 3 bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí, Giáo dục công dân (đối với học sinh chương trình GDPT).
Trong bài thi tổ hợp KHTN, môn Hóa học là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học, trừ khi chọn bài thi tổ hợp KHTN để xét tốt nghiệp hoặc nhằm phục vụ mục tiêu xét tuyển đại học, cao đẳng vào các ngành học có yêu cầu môn Hóa học.
Vì vậy, Đề thi thử tốt nghiệp THPT 2025 môn Hóa học do Trường THPT Yên Phong biên soạn là tài liệu luyện tập quan trọng dành cho các thí sinh lựa chọn tổ hợp KHTN. Đề thi giúp các em ôn luyện kiến thức, tự đánh giá năng lực, rèn luyện kỹ năng làm bài và chuẩn bị sẵn sàng cho kỳ thi chính thức sắp tới.




