Đề thi thử đánh giá năng lực môn Hóa học 2025 – Bám sát đề minh họa – Đề 1 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi này được xây dựng bám sát cấu trúc và nội dung của đề minh họa do Bộ GD&ĐT công bố, giúp học sinh làm quen với dạng thức câu hỏi, mức độ phân hóa và phân bố kiến thức tương tự như đề thi thật. Nội dung bao quát toàn bộ chương trình Hóa học lớp 12, đặc biệt tập trung vào các chuyên đề trọng điểm như: Este – lipit, Polime, Amin và protein, Cacbonhidrat, Kim loại – phản ứng oxi hóa – khử, Nhận biết chất, và các dạng bài tính toán hóa học đặc trưng.
Với mức độ câu hỏi được sắp xếp từ nhận biết – thông hiểu – vận dụng – vận dụng cao, đề thi không chỉ kiểm tra kiến thức cơ bản mà còn đánh giá khả năng tư duy và kỹ năng giải quyết vấn đề của thí sinh. Đây là một trong những tài liệu luyện thi rất sát với thực tế đề thi chính thức, phù hợp để luyện tập tăng tốc giai đoạn nước rút.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 4 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐÁNH GIÁ NĂNG LỰC MÔN HÓA HỌC NĂM 2025 – BÁM SÁT ĐỀ MINH HỌA – ĐỀ 1



PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Trong ăn mòn hóa học, loại phản ứng hóa học xảy ra là phản ứng nào sau đây?
A. Phản ứng thế.
B. Phản ứng oxi hóa- khử.
C. Phản ứng phân hủy.
D. Phản ứng hóa hợp.
Câu 2: Muối nào sau đây không tan trong nước?
A. Na₂SO₄.
B. MgSO₄
C. BeSO₄
D. BaSO₄
Câu 3: Chất có thể trùng hợp tạo ra polymer là
A. CH₃OH.
B. CH₂=CH₂.
C. CH₃COOH.
D. HCOOCH₃
Câu 4: Phát biểu nào sau đây về liên kết kim loại là đúng?
A. Liên kết kim loại là liên kết được hình thành từ lực hút tĩnh điện giữa các cation kim loại và các electron hóa trị tự do. Vì vậy, liên kết kim loại cũng chính là liên kết ion.
B. Liên kết kim loại được hình thành do giữa các nguyên tử kim loại có sự dùng chung các electron hóa trị tự do. Vì vậy, liên kết kim loại cũng chính là liên kết cộng hóa trị.
C. Liên kết kim loại là liên kết được hình thành từ lực hút tĩnh điện giữa các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại.
D. Liên kết kim loại được hình thành do sự xen phủ các orbital chứa electron hóa trị tự do của các nguyên tử kim loại.
Câu 5: Cấu hình electron ở phân lớp ngoài cùng của ion R³⁻ là 2p⁶. Nguyên tử R là
A. Ne.
B. Na.
C. K.
D. Ca.
Câu 6: Cho các chất riêng biệt sau đây: Na₂CO₃ ; HCl ; NaOH; Ba(OH)₂; Na₃PO₄. Số chất có thể làm mềm nước cứng vĩnh cửu là
A. 2.
B. 4.
C. 5.
D. 1.
Câu 7: Túi nylon, nhựa là các polymer tổng hợp có nguồn gốc từ dầu mỏ, thời gian phân hủy trong môi trường lên đến hàng trăm năm, đang gây ô nhiễm môi trường nghiêm trọng. Sau khi học xong chương Polymer (hóa học lớp 12), giáo viên đưa ra chủ đề “Chất thải nhựa: Tác hại và hành động của chúng ta” cho lớp cùng thảo luận. Các bạn trong lớp đưa ra các ý kiến sau:
(1) Có thể tiêu hủy túi nylon và đồ nhựa bằng cách đem đốt chúng sẽ không gây nên sự ô nhiễm môi trường.
(2) Nếu đem đốt túi nylon và đồ làm từ nhựa có thể sinh ra chất độc, gây ô nhiễm: hydrochloric acid, sulfuric acid, dioxin ảnh hưởng đến sức khỏe cộng đồng và làm hại tầng khí quyển.
(3) Túi nylon được làm từ nhựa PE, PP có thêm các chất phụ gia vào để làm túi nylon mềm, dẻo, dai, dễ bị thụy phân trong môi trường nên được khuyến khích sử dụng thay cho các loại túi nylon khác.
(4) Cần có các vật liệu an toàn, dễ tự phân hủy hoặc bị phân hủy sinh học, thí dụ túi làm bằng vật liệu sản xuất từ cellulose.
Có bao nhiêu ý kiến đúng?
A. 1.
B. 2.
C. 3.
D. 4.
Câu 8. Hiện tượng phú dưỡng là một biểu hiện của ao, hồ do dư thừa các chất dinh dưỡng như nitrate và phosphate. Sự dư thừa dinh dưỡng chủ yếu do hàm lượng các ion nào sau đây vượt quá mức cho phép?
A. Na⁺, K⁺.
B. Ca²⁺, Mg²⁺.
C. NO₃⁻, PO₄³⁻.
D. Cl⁻, SO₄²⁻.
Câu 9. Hydrocarbon nào sau đây sẽ có phổ khối như phổ cho dưới đây?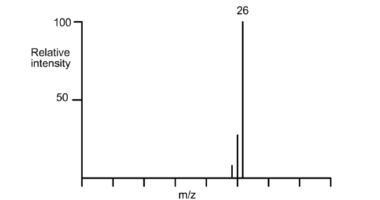 A. CH₄.
A. CH₄.
B. C₂H₂.
C. C₂H₄.
D. C₆H₆.
Câu 10. Khi đun nóng ester X có công thức phân tử C₃H₆O₂ với dung dịch H₂SO₄ đặc thu được metanol. Công thức cấu tạo của X là
A. HCOOC₂H₅.
B. CH₃COOCH₃.
C. C₂H₅COOH.
D. CH₃COOC₂H₅.
Câu 11. Chất nào sau đây thuộc loại amine bậc ba và là chất khí ở điều kiện thường?
A. CH₃NH₂.
B. (CH₃)₃N.
C. CH₃NHCH₃.
D. CH₃CH₂NHCH₃.
Câu 12. Tổng số nguyên tử trong 1 phân tử saccharose là
A. 45.
B. 24.
C. 22.
D. 46.
Câu 13. Một hydrocarbon X mạch hở trong phân tử có phần trăm khối lượng carbon bằng 85,71%. Trên phổ khối lượng của X có peak ion phân tử ứng với giá trị m/z = 42. Công thức phù hợp với X là
A. CH₂=CHCH₃.
B. CH₃CH₂CH₃.
C. CH₂CH₃.
D. CH≡CH.
Câu 14. Tên gọi của ester có công thức cấu tạo thu gọn CH₃COOCH(CH₃)₂ là
A. Propyl acetate.
B. iso-propyl acetate.
C. Sec-propyl acetate.
D. Propyl formate.
Câu 15. Tên thay thế của alanine là
A. α–aminopropionic acid.
B. α–aminopropanoic acid.
C. 2–aminopropionic acid
D. 2–aminopropanoic acid.
Câu 16. Thực hiện một thí nghiệm điện di ở pH = 6 để tách ba amino acid , cho bảng thông tin tin dưới đây: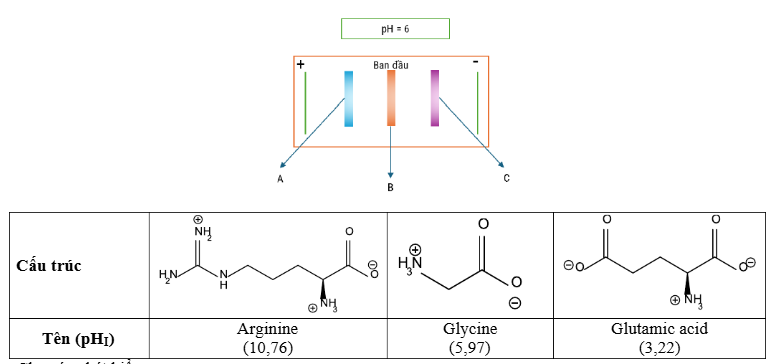 Cho các phát biểu sau:
Cho các phát biểu sau:
(a) Tại pH = 6 thì arginine tồn tại dạng anion.
(b) Tại pH = 6 thì glycine vẫn tồn tại dạng ion lưỡng cực thì có giá trị pI gần bằng 6.
(c) Các vệt A, B, C lần lượt là glutamic acid, glycine, arginine.
(d) Tại pH = 6 thì glutamic acid tồn tại dạng cation và bị hút về cực dương.
Số phát biểu đúng là
A. 3.
B. 2.
C. 1.
D. 4.
Câu 17. Sử dụng thông tin ở bảng dưới đây để trả lời câu hỏi: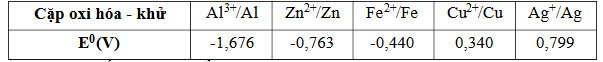 Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây là sai?
Dựa trên bảng thế điện cực chuẩn cho ở trên thì phản ứng nào cho dưới đây là sai?
A. Fe + Cu²⁺ → Fe²⁺ + Cu.
B. Al + 3Ag⁺ → Al³⁺ + 3Ag.
C. Cu + Fe²⁺ → Fe + Cu²⁺.
D. Zn + Fe²⁺ → Zn²⁺ + Fe.
Câu 18. Sử dụng thông tin ở bảng dưới đây để trả lời câu hỏi: Suất điện động chuẩn của pin Galvani thiết lập từ hai cặp oxid hóa – khử trong số các cặp trên là 2,475 V. Hai cặp oxid hoá-khử hình thành pin lần lượt là
Suất điện động chuẩn của pin Galvani thiết lập từ hai cặp oxid hóa – khử trong số các cặp trên là 2,475 V. Hai cặp oxid hoá-khử hình thành pin lần lượt là
A. Al³⁺/Al và Ag⁺/Ag.
B. Zn²⁺/Zn và Al³⁺/Al.
C. Fe²⁺/Fe và Cu²⁺/Cu.
D. Al³⁺/Al và Cu²⁺/Cu.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Trong công nghiệp, xút (sodium hydroxide) được sản xuất bằng phương pháp điện phân dung dịch sodium chloride có màng ngăn xốp. Bằng phương pháp này, người ta cũng thu được khí chlorine. Chất khí này được làm khô (loại hơi nước) rồi hoá lỏng làm nguyên liệu quan trọng cho nhiều ngành công nghiệp chế biến và sản xuất hoá chất.
Từ quá trình điện phân nêu trên, một lượng chlorine và hydrogen sinh ra được tận dụng để sản xuất hydrochloric acid đặc thương phẩm (32%, D = 1,153 g/mL ở 30 °C).
Một nhà máy với quy mô sản xuất 200 tấn xút mỗi ngày thì đồng thời sản xuất được bao nhiêu m³ acid thương phẩm trên. Biết rằng, tại nhà máy này, 60% khối lượng chlorine sinh ra được dùng tổng hợp hydrochloric acid và hiệu suất của toàn bộ quá trình từ chlorine đến acid thương phẩm đạt 80% về khối lượng.
a) Có thể dùng sulfuric acid đặc làm khô khí chlorine thoát ra.
b) Trong thí nghiệm điện phân thì Cl₂ sẽ thoát ra tại cực cathode.
c) Phương trình điện phân của NaCl là 2NaCl + 2H₂O → 2NaOH + H₂ + Cl₂.
d) Giá trị của m là 237 m³ (cho phép làm tròn đến hàng đơn vị).
Câu 2. Nấm men là chất xúc tác cho phản ứng lên men ethyl alcohol trong điều kiện không có khí oxygen. Quá trình lên men là một quá trình tỏa nhiệt.Từ 250 gam glucose, thực hiện quá trình lên men rượu trong phòng thí nghiệm, kết quả biểu diễn theo đồ thị sau: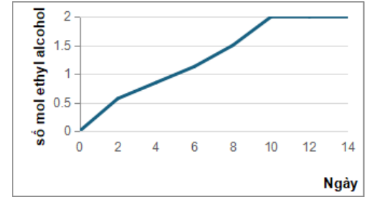
Kết quả nghiên cứu nhận thấy:
• Tốc độ phản ứng tăng lên và dung dịch trở nên đặc và ấm hơn.
• Sau một thời gian từ ngày thứ 10 phản ứng hầu như dừng lại dù trong dung dịch vẫn còn glucose.
a) Phương trình lên men glucose là : C₆H₁₂O₆ –(men rượu)→ 2C₂H₅OH + CO₂
b) Trong quá trình lên men ngoài trừ ethyl alcohol thì còn có thể tạo thành một số sản phẩm như CH₃CHO, CH₃COOH, CH₃COOC₂H₅.
c) Dung dịch trở nên đặc hơn là do khí CO₂ bay ra làm khối lượng dung dịch tăng lên nên nồng độ dung dịch tăng lên.
d) Hiệu suất lên men của ngày thứ 10 là 78%.
Câu 3. Ba hợp chất thơm A, B, C đều có ứng dụng trong thực tiễn: A có tác dụng chống sinh vật kí sinh (chấy, rận); B làm chất tạo mùi hạnh nhân; C là một thành phần của thuốc mỡ Whitfield, được dùng để điều trị các bệnh về da như nấm da, giun đũa và chân của vận động viên. Cho biết A là một alcohol bậc I có CTCT là C₆H₅CH₂OH. Sơ đồ chuyển hoá giữa ba chất A, B, C như sau: A –(+CuO, t⁰)→ B –(O)→ C
a) Chất C là một aldehyde có tên thường là benzaldehyde.
b) Phổ IR của A có peak hấp thụ ở vùng 3500-3200 cm⁻¹
c) Chất B có tín hiệu peak đặc trưng ở vùng 1700 cm⁻¹ và peak ở vùng 2650 – 2880 cm⁻¹.
d) Có thể phân biệt chất B và C bằng phổ IR.
Câu 4. Muối FeCl₃ khan là những tinh thể có màu vàng nâu. Hoà tan một lượng muối này vào nước, thu được dung dịch có màu vàng nhạt (có chứa phức chất X). Lấy một ít dung dịch muối trên cho vào dung dịch KSCN thì thấy xuất hiện màu đỏ đặc trưng, để giải thích hiện tượng trên là do xảy ra sự tạo phức như sau:
Fe³⁺ + SCN⁻ ⇌ [Fe(SCN)]²⁺
a) Phức chất X là phức chất của Fe³⁺ và phối tử H₂O.
b) Dung dịch chứa phức X có môi trường base.
c) Trong môi trường base thì phức [Fe(SCN)]²⁺ khó hình thành hơn vì ion Fe³⁺ sẽ tạo kết tủa Fe(OH)₃ làm giảm nồng độ ion Fe³⁺
d) Phản ứng trên dùng nhận biết ion Fe³⁺ cũng như nhận biết ion SCN⁻.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1. Trong các nhà máy cung cấp nước sinh hoạt thì khâu cuối cùng của việc xử lí nước là khử trùng nước. Một trong các phương pháp khử trùng nước đang được sử dụng là dùng chlorine. Giả sử lượng chlorine được bơm vào nước trong bể để xử lí theo tỉ lệ 5 g/m³. Nếu mỗi người dùng trung bình 60 lít nước/ngày, thì các nhà máy cung cấp nước sinh hoạt cần dùng bao nhiêu tiền để mua chlorine cho việc xử lí nước mỗi ngày của 1 hộ gia đình trung bình 4 người( đơn vị VNĐ )? Cho biết 1 thùng chlorine 45 kg loại Nhất có giá 2.700.000 VNĐ.
Câu 2 Đun nóng một loại mỡ động vật với dung dịch KOH , sản phẩm thu được có chứa muối potassium linoleate (C₁₇H₃₁COOK). Phân tử khối của potassium linoleate là bao nhiêu?
Câu 3. Cho các phản ứng sau:
(a) 2C₆H₁₂O₆ + Cu(OH)₂ → Cu(C₆H₁₁O₆)₂ + 2H₂O (glucose)
(b) C₆H₁₂O₆ + 2 [Ag (NH₃)₂] OH⁻ —(t⁰)→ CH₂OH(CHOH)₄COONH₄ + 2Ag + 3NH₃ + H₂O (glucose)
(c) C₆H₁₂O₆ + H₂ —(Ni, t⁰)→ C₆H₁₄O₆ (glucose)
(d) 2 C₆H₁₂O₆ + Br₂ + H₂O → CH₂OH[CHOH]₄COOH + 2HBr (glucose)
Có bao nhiêu phản ứng mà trong đó glucose thể hiện tính oxi hoá?
Câu 4. Có bao nhiêu đồng phân cấu tạo của amine ứng với công thức phân tử C₄H₁₁N tác dụng với dung dịch hỗn hợp HCl và NaNO₂ sinh ra chất khí?
Câu 5. Xăng E5 là một loại xăng sinh học, được tạo thành khi trộn 5 thể tích C₂H₅OH (D = 0,8 g/mL) với 95 thể tích xăng truyền thống. Giả sử xăng truyền thống chỉ chứa hai alkane C₈H₁₈ và C₉H₂₀ (tỷ lệ mol tương ứng 3 : 4, D = 0,7 g/mL). Biết nhiệt lượng tỏa ra khi đốt cháy 1 mol các chất trong xăng E5 như sau: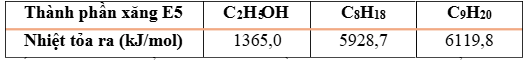
Trung bình, một chiếc xe máy di chuyển được 1 km thì cần một nhiệt lượng chuyển thành công cơ học có độ lớn là 211,8 kJ. Nếu chiếc xe máy đó đi chuyến từ Đà Nẵng đến Huế với quãng đường là 100 km thì hết khoảng bao nhiêu lít xăng? (biết hiệu suất sử dụng nhiên liệu của động cơ xe máy là 30%).
Câu 6. Chất tẩy rửa thông dụng thường có chứa hydrochloric acid. Lấy 25 mL chất tẩy rửa pha thành 250 mL trong bình định mức.
Cho 20 mL dung dịch sodium carbonate 0,448M vào bình nón. Thêm chỉ thị methyl da cam vào bình và chuẩn độ bằng dung dịch tẩy rửa đã pha loãng bên trên. Tiến hành chuẩn độ đến khi nào chỉ thị từ màu vàng sang màu hồng, sau 3 lần chuẩn độ thì thể tích chất tẩy rửa trung bình đã dùng là 19,84 mL. Tính nồng độ hydrochloric acid trong chất tẩy rửa.
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh cho các cơ sở giáo dục đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục ở các địa phương và trên phạm vi toàn quốc, từ đó điều chỉnh nội dung chương trình và phương pháp dạy học trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 bắt buộc phải tham gia 3 bài thi chính: Toán, Ngữ văn và Ngoại ngữ.
Bên cạnh đó, thí sinh phải chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học và Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí và Giáo dục công dân (áp dụng với học sinh chương trình GDPT).
Nếu thí sinh lựa chọn bài thi tổ hợp KHTN, môn Hóa học sẽ là một trong ba môn thi thành phần. Tuy nhiên, môn Hóa học không bắt buộc nếu thí sinh không chọn tổ hợp KHTN. Việc thi môn Hóa là cần thiết đối với những học sinh chọn tổ hợp KHTN để xét tốt nghiệp hoặc xét tuyển đại học, cao đẳng vào các ngành có yêu cầu về điểm thi môn Hóa học.
Do đó, “Đề ôn thi tốt nghiệp THPT 2025 môn Hóa học – Bám sát đề minh họa – Đề 1” được xây dựng như một tài liệu luyện tập hữu ích dành cho thí sinh chọn tổ hợp KHTN. Đề thi giúp các em ôn tập kiến thức trọng tâm, làm quen với cấu trúc và dạng câu hỏi tương tự đề minh họa của Bộ GD&ĐT, từ đó nâng cao kỹ năng làm bài và chuẩn bị vững vàng cho kỳ thi chính thức.




