Đề thi thử đánh giá năng lực môn Hóa học 2025 – Bám sát đề minh họa – Đề 2 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề thi bao phủ toàn bộ các chuyên đề trọng tâm trong chương trình Hóa học lớp 12 như: este – lipit, amin – amino axit – peptit, polime, kim loại, phi kim, phản ứng oxi hóa – khử, điện phân, đại cương hóa hữu cơ và hóa vô cơ. Các câu hỏi được phân bố hợp lý theo các mức độ từ nhận biết – thông hiểu đến vận dụng – vận dụng cao, đảm bảo độ phân hóa phù hợp với kỳ thi tốt nghiệp THPT và xét tuyển đại học.
Hãy cùng Dethitracnghiem.vn khám phá ngay đề thi này để kiểm tra năng lực bản thân và luyện tập một cách bài bản, chuẩn bị vững vàng cho kỳ thi tốt nghiệp THPT 2025!
- Số trang: 4 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐÁNH GIÁ NĂNG LỰC MÔN HÓA HỌC NĂM 2025 – BÁM SÁT ĐỀ MINH HỌA – ĐỀ 2




PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Kim cương là một dạng thù hình được biết đến nhiều nhất của nguyên tố carbon. Kim cương có độ cứng rất cao, độ khúc xạ cực tốt nên được ứng dụng trong các ngành công nghiệp và đặc biệt làm đồ trang sức có giá trị kinh tế rất cao. Nguyên tử của nguyên tố carbon có số hiệu nguyên tử là 6 và số khối là 12. Tổng số hạt proton, electron và neutron trong nguyên tử carbon là
A. 38.
B. 28.
C. 18.
D. 49.
Câu 2: Cho các phát biểu sau:
(a) Thực phẩm bảo quản trong tủ lạnh sẽ giữ được lâu hơn.
(b) Hầm xương bằng nồi áp suất sẽ nhanh nhừ hơn.
(c) Bệnh nhân dễ hô hấp hơn khi dùng oxygen từ bình chứa khí oxygen so với từ không khí.
Các yếu tố chính ảnh hưởng đến tốc độ phản ứng trong các quá trình trên lần lượt là
A. nhiệt độ, áp suất, nồng độ.
B. nhiệt độ, nhiệt độ, áp suất.
C. áp suất, nhiệt độ, nồng độ.
D. nhiệt độ, nồng độ, áp suất.
Câu 3: Alkene CH₃–CH=CH–CH₃ có tên là
A. 2-methylprop–2–ene.
B. but–2–ene.
C. but–1–ene.
D. but–3–ene.
Câu 4: Sulfuric acid là một hóa chất quan trọng trong công nghiệp, được dùng để sản suất phân bón, khai khoáng, chế biến dầu mỏ. Trong công nghiệp sulfuric acid được sản xuất với nồng độ từ 70% đến 98% từ sulfur, bằng quá trình tiếp xúc và thiết bị phản ứng dòng liên tục qua 3 giai đoạn sau đây:
– Giai đoạn 1: Đốt sulfur với không khí khô và sạch tạo ra chất X.
– Giai đoạn 2: Nung X với oxygen dư trong lò tầng ở 450°C–500°C, có V₂O₅ xúc tác thu được chất Y.
– Giai đoạn 3: Dùng chất Z để hấp thụ Y, tạo ra chất T rồi cho T kết hợp với lượng nước vừa đủ tạo ra H₂SO₄ có nồng độ như yêu cầu sản xuất.
Chất Z và chất T nêu trên lần lượt là:
A. H₂O và oleum.
B. H₂SO₄ loãng và oleum.
C. H₂SO₄ đặc và oleum.
D. H₂O và H₂SO₄ > 98%.
Câu 5: Chất béo là triester của acid béo với
A. methyl alcohol.
B. ethylene glycol.
C. ethyl alcohol.
D. glycerol.
Câu 6: Mỗi đơn vị glucose trong cellulose liên kết với nhau bởi liên kết
A. α–1,6–glycoside.
B. α–1,4–glycoside.
C. β–1,2–glycoside.
D. β–1,4–glycoside.
Câu 7: Cặp chất nào sau đây có thể phân biệt bằng thuốc thử Tollens?
A. Glucose và maltose.
B. Tinh bột và cellulose.
C. Saccharose và glucose.
D. Glucose và fructose.
Câu 8: Dung dịch methyl amine trong nước làm
A. quì tím không đổi màu.
B. quì tím hoá xanh.
C. phenolphthalein hoá xanh.
D. phenolphthalein không đổi màu.
Câu 9: Phát biểu nào sau đây không đúng?
A. Thuỷ phân hoàn toàn protein thu được các phân tử α–amino acid.
B. Protein tác dụng với Cu(OH)₂ trong môi trường kiềm tạo dung dịch màu xanh lam.
C. Protein bị đông tụ khi đun nóng ở nhiệt độ cao.
D. Protein tác dụng với nitric acid đặc tạo kết tủa vàng.
Câu 10: Vật liệu nào sau đây được chế tạo từ polymer trùng ngưng?
A. Cao su isoprene.
B. Polyethylene.
C. Tơ nitron.
D. Nylon–6,6.
Câu 11: Trong quá trình mạ vàng (mạ vàng) một vật bằng đồng, người ta dùng cathode là vật bằng đồng, anode làm bằng vàng, dung dịch điện li là dung dịch muối vàng (AuCl₃ chẳng hạn). Phương trình hóa học của phản ứng xảy ra ở điện cực âm là:
A. Au³⁺ + 3e → Au.
B. Au → Au³⁺ + 3e.
C. Cu²⁺ + 2e → Cu.
D. Cu → Cu²⁺ + 2e.
Câu 12: Cho E⁰(Zn²⁺/Zn) = − 0,76V; E⁰(Cu²⁺/Cu) = + 0,34V. Suất điện động chuẩn của pin điện hóa Cu-Ag là
A. 0,46V.
B. 0,56V.
C. 1,14V.
D. 0,34V.
Câu 13: Kim loại nào sau đây có nhiệt độ nóng chảy cao nhất?
A. Au.
B. Pt.
C. Cr.
D. W.
Câu 14: Xét các cặp oxi hóa – khử sau:
Kim loại có tính khử mạnh nhất, yếu nhất lần lượt là
A. Mg, Ag.
B. Al, Ag.
C. Al, Fe.
D. Mg, Fe.
Câu 15: Kim loại nào sau đây là kim loại kiềm?
A. K.
B. Ba.
C. Al.
D. Ca.
Câu 16: Dãy gồm các chất đều có thể làm mất tính cứng tạm thời của nước là
A. NaOH, Na₃PO₄, Na₂CO₃.
B. HCl, Ca(OH)₂, Na₂CO₃.
C. KCl, Ca(OH)₂, Na₂CO₃.
D. HCl, NaOH, Na₂CO₃.
Câu 17: Đồ thị nhiệt độ nóng chảy của các nguyên tố kim loại chu kì 4 (từ nhóm IA đến IB)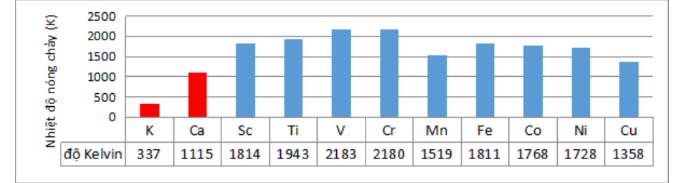
Dựa vào đồ thị, nhận định nào đúng trong các nhận định sau:
A. Nhiệt độ nóng chảy của nguyên tố Sc > gần bằng kim loại chuyển tiếp.
B. Nhiệt độ nóng chảy của nguyên tố s cao hơn kim loại chuyển tiếp.
C. Nhiệt độ nóng chảy của nguyên tố p thấp hơn kim loại chuyển tiếp.
D. Nhiệt độ nóng chảy tăng dần theo chiều tăng của điện tích hạt nhân.
Câu 18: Phát biểu nào sau đây đúng?
A. Phức chất aqua là phức chất chứa phối tử NH₃.
B. Phức chất của kim loại chuyển tiếp đều tan trong dung dịch.
C. Muối CuSO₄ khan màu trắng khi tan vào nước tạo thành dung dịch có màu xanh do tạo thành phức chất aqua
D. Phức chất của kim loại chuyển tiếp đều có màu.
Phần II. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a, b, c, d ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1: Từ xa xưa con người đã biết lên men các loại ngũ cốc hoa quả để tạo ra các đồ uống có cồn (có chứa ethanol – một alcohol quen thuộc). Ngày nay, alcohol được sử dụng phổ biến trong nhiều lĩnh vực khác nhau như làm dung môi, nguyên liệu hóa học, nhiên liệu, xăng sinh học.
a) Trong đời sống rượu ethylic (ethanol) được điều chế từ phản ứng lên men cơm gạo, cơm nếp, hoặc một số loại trái cây.
b) Các alcohol thường có nhiệt độ sôi cao hơn so với hydrocarbon và dẫn xuất halogen có phân tử khối tương đương và dễ tan trong nước.
c) Nhiều vụ ngộ độc do uống phải rượu pha chế từ cồn công nghiệp do có chứa methanol gây độc.
d) Đun nóng isoamylic alcohol và acetic acid với xúc tác sulfuric acid đặc thu được ester có mùi chuối chín dùng trong công nghiệp thực phẩm.
Câu 2: Trong dung dịch, tồn tại cân bằng hóa học giữa ion lưỡng cực và các dạng ion tồn tại của amino acid. Các dạng tồn tại của alanine ở các dạng pH khác nhau.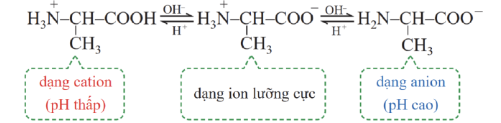
a) Ở điều kiện thường alanine tồn tại ở thể rắn, có nhiệt độ nóng chảy cao.
b) Alanine phản ứng được với dung dịch NaOH.
c) Trong môi trường acid mạnh alanine tồn tại chủ yếu ở dạng anion di chuyển về phía cực dương dưới tác dụng của điện trường.
d) Alanine là amino acid không thiết yếu (tự cơ thể tổng hợp được) và rất quan trọng trong việc hình thành nên protein cho cơ thể.
Câu 3: Ăn mòn hóa học thường xảy ra ở các chi tiết bằng kim loại của máy móc dùng trong các nhà máy sản xuất hóa chất, những bộ phận của thiết bị lò đốt, nồi hơi, các chi tiết của động cơ đốt trong hoặc những thiết bị thường xuyên phải tiếp xúc với hơi nước, khí oxygen, …
Ví dụ phản ứng xảy ra trong sự ăn mòn hóa học của kim loại iron:
(1) 3Fe + 2O₂ —(t⁰)→ Fe₃O₄
(2) 3Fe + 4H₂O —(t⁰)→ Fe₃O₄ + 4H₂
Hãy cho biết trong các nhận định sau, nhận định nào đúng, nhận định nào sai?
a) Trong phản ứng (1) và (2), Fe đều đóng vai trò chất khử.
b) Phản ứng (1) và (2) đều thuộc loại phản ứng oxi hóa – khử.
c) Các vật dụng bằng sắt thường dễ bị gỉ, để bảo vệ sắt không bị gỉ người ta thường ngâm sắt trong giấm ăn hoặc chanh sau khi sử dụng.
d) Để bảo vệ các tàu thép không bị ăn mòn khi giao thông đường biển, người ta thường áp các tấm kẽm bên ngoài để tránh hiện tượng ăn mòn.
Câu 4: Kim loại nhóm IA còn gọi là kim loại kiềm, bao gồm các nguyên tố Li, Na, K, Rb và Cs. Kim loại kiềm và hợp chất của chúng có nhiều ứng dụng trong cuộc sống.
a) Có thể nhận biết hợp chất của kim loại nhóm IA bằng màu ngọn lửa.
b) Quá trình điện phân dung dịch NaCl bão hòa có màng ngăn điện cực được ứng dụng để sản xuất nước Javel.
c) Trộn một số muối hoặc oxide của các kim loại nhóm IA để tạo màu sắc cho pháo hoa.
d) Sodium carbonate (Na₂CO₃) có thể tách loại ion Fe³⁺ ra khỏi nước ở dạng kết tủa Fe(OH)₃ trong quá trình xử lí nước nhiễm phèn.
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: Xét phản ứng 2CO(g) → CO₂(g) + C(r) trong bình kín, nhiệt độ không đổi. Nếu áp suất của hệ tăng 3 lần thì tốc độ phản ứng sẽ tăng bao nhiêu lần?.
Câu 2: Xà phòng và chất giặt rửa tổng hợp đều có tác dụng giặt rửa. Dưới đây là ví dụ về cấu tạo của xà phòng và chất giặt rửa.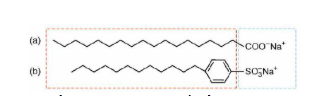
Xà phòng và chất giặt rửa tổng hợp làm sạch các vết bẩn nhờ vào các phản ứng hóa học.
Khi xà phòng, chất giặt rửa tan vào nước sẽ tạo dung dịch có sức căng bề mặt lớn làm cho vật cần giặt rửa dễ thấm ướt.
Cả 2 đều có cấu tạo chung là gồm 2 phần: đầu ưa nước và đuôi kị nước.
Đuôi kị nước của xà phòng/ chất giặt rửa hướng về phía nước để chúng có thể bị rửa trôi.
Có bao nhiêu phát biểu đúng trong các phát biểu trên?.
Câu 3: Sự hình thành và chuyển hóa tinh bột
Trong cây xanh, dưới tác dụng của chlorophyll (diệp lục), khí carbon dioxide kết hợp với nước để tạo thành tinh bột.
Đối với con người, trong khoang miệng, dưới tác dụng của enzyme, tinh bột bị thủy phân thành glucose.
Trong cơ thể người, sản phẩm cuối cùng của sự thủy phân tinh bột là glycogen.
Khi cơ thể thiếu hụt dinh dưỡng, sẽ xảy ra quá trình thủy phân glycogen để cung cấp glucose cho cơ thể.
Có bao nhiêu phát biểu đúng trong sự hình thành và chuyển hóa tinh bột?.
Câu 4: Người ta điều chế Al từ một quặng có chứa 15% tạp chất trơ. Biết hiệu suất phản ứng đạt 85%. Khối lượng Al thu được từ 4 tấn quặng trên là bao nhiêu tấn?.
Câu 5: Hạ nhiệt độ 128,3 gam dung dịch Na₂SO₄ bão hòa ở 80°C xuống 10°C thấy có m gam tinh thể Na₂SO₄.10H₂O tách ra. Biết độ tan của Na₂SO₄ ở 80°C là 28,3 gam và ở 10°C là 9,0 gam. Giá trị của m là bao nhiêu?.
Câu 6: Để xác định định hàm lượng muối Fe(II) trong 1 mẫu dung dịch A có thể dùng dung dịch thuốc tím KMnO₄, phương trình ion như sau:
MnO₄⁻ + 5Fe²⁺ + 8H⁺ → Mn²⁺ + 5Fe³⁺ + 4H₂O
Người ta lấy 25,00 mL dung dịch A chứa muối sắt²⁺ cho vào bình định mức, thêm nước cất cho đủ 100 mL, dung dịch thu được gọi là dung dịch X. Lấy 10,00 mL từ dung dịch X chuyển vào bình tham giác. Thêm khoảng 5mL dung dịch H₂SO₄ 2M. Tiến hành chuẩn độ 3 lần bằng dung dịch KMnO₄ 0,02M. Kết quả thể tích KMnO₄ sau 3 lần chuẩn độ lần lượt là 20,50 mL; 20,55 mL; 20,55 mL. Tính hàm lượng muối Fe²⁺ (g/L) trong dung dịch A
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ tuyển sinh cho các cơ sở giáo dục đại học, cao đẳng.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên phạm vi toàn quốc, từ đó điều chỉnh nội dung chương trình và phương pháp dạy học trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ GD&ĐT, thí sinh dự thi Tốt nghiệp THPT năm 2025 bắt buộc phải tham gia 3 bài thi chính: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh phải chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học và Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí và Giáo dục công dân (đối với học sinh chương trình GDPT).
Nếu thí sinh lựa chọn bài thi tổ hợp KHTN, môn Hóa học sẽ là một trong ba môn thành phần. Tuy nhiên, thí sinh không bắt buộc phải thi môn Hóa học nếu không chọn tổ hợp KHTN. Việc thi môn Hóa học là cần thiết đối với những thí sinh xét tốt nghiệp theo bài thi KHTN hoặc xét tuyển vào các ngành đại học, cao đẳng có yêu cầu điểm thi môn Hóa học.
Vì vậy, “Đề thi tốt nghiệp THPT 2025 môn Hóa học – Bám sát đề minh họa – Đề 2” được xây dựng nhằm hỗ trợ học sinh chọn tổ hợp KHTN trong quá trình ôn thi. Đề thi bám sát cấu trúc và nội dung đề minh họa do Bộ GD&ĐT công bố, giúp học sinh rèn luyện kỹ năng làm bài, củng cố kiến thức trọng tâm và chuẩn bị sẵn sàng cho kỳ thi chính thức.




