Đề thi thử đánh giá năng lực môn Hóa học 2025 – Bám sát đề minh họa – Đề 3 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Trong đề thi này, học sinh sẽ được tiếp cận với các câu hỏi bao quát toàn bộ chương trình Hóa học lớp 12, đặc biệt là các chuyên đề thường xuất hiện trong các đề thi chính thức như: este – lipit, amin – amino axit – peptit, polime, điện phân, phản ứng oxi hóa – khử, kim loại, phi kim và hóa học đại cương. Với cấu trúc hợp lý, đề thi phân bố tỷ lệ câu hỏi theo các mức độ từ dễ đến khó, giúp phân loại năng lực thí sinh hiệu quả và phù hợp để xét tuyển đại học.
Hãy cùng Dethitracnghiem.vn tìm hiểu chi tiết nội dung đề số 3 và bắt tay vào luyện tập ngay hôm nay để chinh phục kỳ thi tốt nghiệp THPT 2025 một cách tự tin và hiệu quả!
- Số trang: 4 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐÁNH GIÁ NĂNG LỰC MÔN HÓA HỌC NĂM 2025 – BÁM SÁT ĐỀ MINH HỌA – ĐỀ 3



PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án.
Câu 1: Ester ethyl formate có mùi thơm của đào và có thành phần trong hương vị của quả mâm xôi, đôi khi nó còn được tìm thấy trong táo, ester này có công thức là
A. CH₃COOCH₃.
B. HCOOC₂H₅.
C. HCOOCH=CH₂.
D. HCOOCH₃.
Câu 2: Phản ứng giữa C₂H₅OH với CH₃COOH (xúc tác H₂SO₄ đặc, đun nóng) là phản ứng
A. Xà phòng hóa.
B. ester hóa.
C. Trùng hợp.
D. Trùng ngưng
Câu 3: Chất thuộc loại disaccharide là
A. glucose.
B. saccharose.
C. cellulose.
D. fructose.
Câu 4: Tên gọi và bậc của amine có công thức cấu tạo CH₃-CH₂-NH₂
A. methylamine, bậc I.
B. ethylamine, bậc I.
C. ethylamine, bậc I.
D. ethaneamine, bậc II.
Câu 5: Amino acid là hợp chất hữu cơ trong phân tử
A. chứa nhóm carboxyl và nhóm amino.
B. chỉ chứa nhóm amino.
C. chỉ chứa nhóm carboxyl và nhóm amino.
D. chỉ chứa nitrogen hoặc carbon.
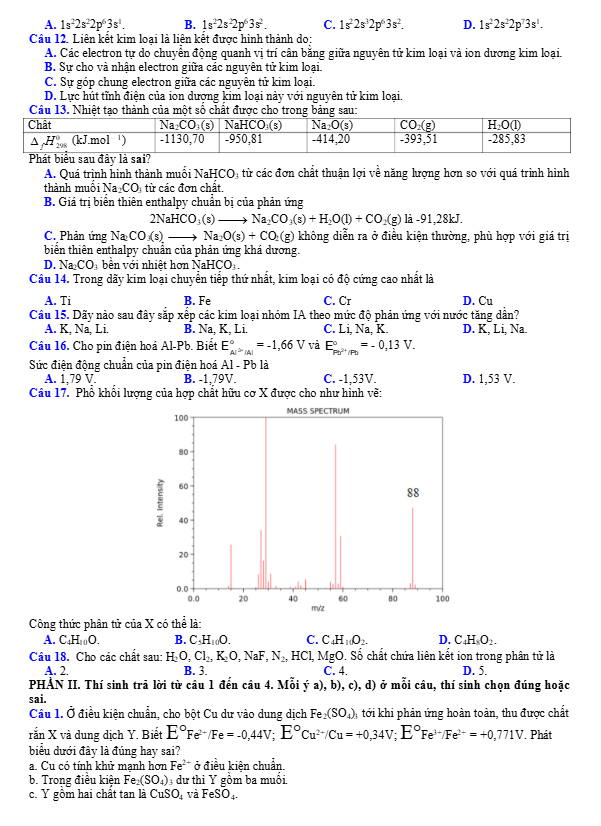
Câu 6: Cho dung dịch chứa amino acid X tồn tại ở dạng ion lưỡng cực: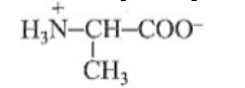
Đặt dung dịch này trong một điện trường. Khi đó:
A. Chất X sẽ di chuyển về phía cực âm của điện trường.
B. Chất X sẽ di chuyển về phía cực dương của điện trường.
C. Chất X không di chuyển dưới tác dụng của điện trường.
D. Chất X chuyển hoàn toàn về dạng H₂NCH(R)COOH.
Câu 7: So sánh, phân loại, lựa chọn được các đối tượng, khái niệm hoặc quá trình hoá học theo các tiêu chí khác nhau.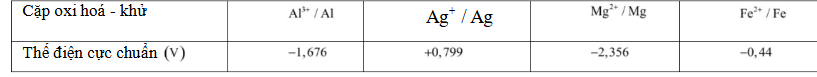 Xét các cặp oxi hoá – khử sau:Kim loại có tính khử mạnh nhất, yếu nhất lần lượt là
Xét các cặp oxi hoá – khử sau:Kim loại có tính khử mạnh nhất, yếu nhất lần lượt là
A. Mg, Ag.
B. Al, Ag.
C.Al, Fe
D. Mg, Fe
Câu 8: Tên gọi của polymer có công thức cho dưới đây là![]()
A. Cao su buna.
B. Cao su buna-S.
C. Polyethylene.
D. Cao su isoprene .
Câu 9: Cho các chất sau: CH₂=CHCl; CH₂ = CH – CH₃, CH₂=CH–CH=CH₂; H₂N[CH₂]₅COOH.
Số chất có khả năng tham gia phản ứng trùng hợp là
A. 2.
B. 1.
C. 4.
D. 3
Câu 10. Một học sinh tiến hành thí nghiệm: Nhúng một thanh đồng vào dung dịch AgNO₃, sau một lúc nhúng tiếp một thanh sắt vào dung dịch này đến phản ứng hoàn toàn. Sau khi thí nghiệm kết thúc, học sinh đó rút ra các kết luận sau :
(1) Dung dịch thu được sau phản ứng có màu xanh nhạt.
(2) Khối lượng thanh đồng bị giảm sau phản ứng.
(3) Khối lượng thanh sắt tăng lên sau phản ứng.
Số kết luận không đúng là
A. 0.
B. 1.
C. 2.
D. 3.
Câu 11. Ở trạng thái cơ bản, cấu hình electron của nguyên tử Mg (Z = 12) là
A. 1s²2s²2p⁶3s¹.
B. 1s²2s²2p⁶3s².
C. 1s²2s32p⁶3s².
D. 1s²2s²2p⁷3s¹.
Câu 12. Liên kết kim loại là liên kết được hình thành do:
A. Các electron tự do chuyển động quanh vị trí cân bằng giữa nguyên tử kim loại và ion dương kim loại.
B. Sự cho và nhận electron giữa các nguyên tử kim loại.
C. Sự góp chung electron giữa các nguyên tử kim loại.
D. Lực hút tĩnh điện của ion dương kim loại này với nguyên tử kim loại.
Câu 13. Nhiệt tạo thành của một số chất được cho trong bảng sau:![]()
Phát biểu sau đây là sai?
A. Quá trình hình thành muối NaHCO₃ từ các đơn chất thuận lợi về năng lượng hơn so với quá trình hình thành muối Na₂CO₃ từ các đơn chất.
B. Giá trị biến thiên enthalpy chuẩn bị của phản ứng 2NaHCO₃(s) → Na₂CO₃(s) + H₂O(l) + CO₂(g) là +91,58kJ.
C. Phản ứng Na₂CO₃(s) → Na₂O(s) + CO₂(g) không diễn ra ở điều kiện thường, phù hợp với giá trị biến thiên enthalpy chuẩn của phản ứng khá dương. (ΔrH⁰ = +322.99 kJ
D. Na₂CO₃ bền với nhiệt hơn NaHCO₃.
Câu 14. Trong dãy kim loại chuyển tiếp thứ nhất, kim loại có độ cứng cao nhất là
A. Ti
B. Fe
C. Cr
D. Cu
Câu 15. Dãy nào sau đây sắp xếp các kim loại nhóm IA theo mức độ phản ứng với nước tăng dần?
A. K, Na, Li.
B. Na, K, Li.
C. Li, Na, K.
D. K, Li, Na.
Câu 16. Cho pin điện hoá Al-Pb. Biết E⁰Al³⁺/Al = −1,66 V và E⁰Pb²⁺/Pb = − 0,13 V.
Suất điện động chuẩn của pin điện hoá Al – Pb là
A. 1,79 V.
B. –1,79V.
C. –1,53V.
D. 1,53 V.
Câu 17. Phổ khối lượng của hợp chất hữu cơ X được cho như hình vẽ:
Công thức phân tử của X có thể là:
A. C₄H₁₀O.
B. C₃H₁₀O.
C. C₄H₁₀O₂.
D. C₄H₈O₂.
Câu 18. Cho các chất sau: H₂O, Cl₂, K₂O, NaF, N₂, HCl, MgO. Số chất chứa liên kết ion trong phân tử là
A. 2.
B. 3.
C. 4.
D. 5.
PHẦN II. Thí sinh trả lời từ câu 1 đến câu 4. Mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
Câu 1. Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe₂(SO₄)₃ tới khi phản ứng hoàn toàn, thu được chất rắn X và dung dịch Y. Biết E⁰Fe²⁺/Fe = –0,44V; E⁰Cu²⁺/Cu = +0,34V; E⁰Fe³⁺/Fe²⁺ = +0,771V. Phát biểu dưới đây là đúng hay sai?
a. Cu có tính khử mạnh hơn Fe²⁺ ở điều kiện chuẩn.
b. Trong điều kiện Fe₂(SO₄)₃ dư thì Y gồm ba muối.
c. Y gồm hai chất tan là CuSO₄ và FeSO₄.
d. X gồm hai kim loại.
Câu 2. X là một peptide mạch hở có công thức phân tử C₁₃H₂₄N₄O₆. Thực hiện các phản ứng sau (theo đúng tỉ lệ mol các chất):
(1) X + 4NaOH → X1 + H₂NCH₂COONa + X2 + 2H₂O.
(2) X1 + 3HCl → C₅H₁₀NO₄Cl + 2NaCl.
a. X là một tetrapeptide.
b. X₁ được ứng dụng làm mì chính (bột ngọt).
c. Trong dung dịch, X₁ làm quỳ tím hóa đỏ.
d. X₂ tác dụng với dung dịch HCl theo tỉ lệ mol tương ứng 1 : 3.
Câu 3. Hoà tan 0,422g mẫu khoáng vật của sắt trong dung dịch sulfuric acid dư, sao cho tất cả lượng sắt có trong quặng đều chuyển thành Fe²⁺, thu được dung dịch A. Chuẩn độ Fe²⁺ trong dung dịch A bằng chất chuẩn là dung dịch thuốc tím KMnO₄ 0,040M. Khi đã sử dụng 23,50mL thì phản ứng vừa qua điểm tương đương.
5Fe²⁺(aq) + MnO₄⁻(aq) + 8H⁺(aq) → 5Fe³⁺(aq) + Mn²⁺(aq) + 4H₂
Mỗi phát biểu dưới đây là đúng hay sai?
a. Nếu chỉ có Fe²⁺ trong dung dịch A tác dụng được với thuốc tím thì việc chuẩn độ dung dịch A sẽ giúp xác định được lượng nguyên tố sắt trong mẫu khoáng vật. Từ đó tính được % (theo khối lượng) của nguyên tố sắt có trong mẫu khoáng vật là 60,26 %.
b. Trong quá trình chuẩn độ trên, cần nhỏ từ từ dung dịch thuốc tím từ burette vào bình tam giác chứa dung dịch A.
c. Cần thêm chất chỉ thị phù hợp vào bình tam giác chứa dung dịch A để xác định được thời điểm kết thúc quá trình chuẩn độ.
d. Cần lặp lại thí nghiệm chuẩn độ 2 lần để bảo đảm tính chính xác của kết quả.
Câu 4. Một nhóm học sinh đã thực hiện phản ứng điều chế ethyl acetate từ nguyên liệu ban đầu là acetic acid và ethanol trong phòng thí nghiệm. Khi phản ứng kết thúc, nhóm đã thu được hỗn hợp sản phẩm gồm ethyl acetate và acetic acid, ethanol còn dư theo phương trình hoá học:
CH₃COOH + C₂H₅OH ⇌ CH₃COOC₂H₅ + H₂O
Vì ethyl acetate không phân cực, còn acetic acid và ethanol đều phân cực nên nhóm đã dùng dung môi hữu cơ không phân cực diethyl ether (C₂H₅OC₂H₅) để chiết ethyl acetate ra khỏi hỗn hợp sau phản ứng theo sơ đồ sau: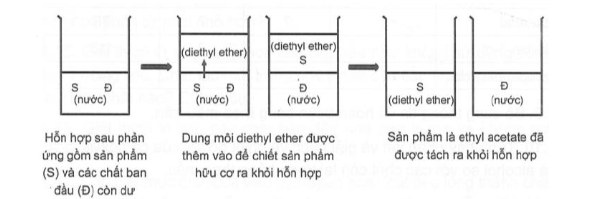
Chọn tính đúng sai cho các phát biểu sau về thí nghiệm của nhóm:
a) Diethyl ether là dung môi chiết lí tưởng trong thí nghiệm trên vì ethyl acetate tan tốt trong dung môi này, còn acetic acid và ethanol lại tan tốt trong nước.
b) Bằng phương pháp chưng cất đơn giản, ta có thể tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
Câu 4. (Tiếp theo)
c) Do diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate (34,6°C so với 77,1°C) nên có thể thu được ethyl acetate sau khi chiết bằng cách dùng đèn cồn đun nhẹ cho dung môi diethyl ether bay hơi.
d) Để an toàn, ta có thể dùng nước nóng liên tục tưới lên bình cầu trong phương pháp chưng cất đơn giản để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
PHẦN III. Thí sinh trả lời từ câu 1 đến câu 6
Câu 1. Cho dãy các dung dịch: glucose, saccharose, ethanol, glycerol. Số dung dịch trong dãy phản ứng được với Cu(OH)₂ ở nhiệt độ thường tạo thành dung dịch có màu xanh lam là
Câu 2. Amine đơn chức X có chứa vòng benzene. Cho X tác dụng với HCl dư thu được muối Y có công thức RNH₃Cl. Cho a gam Y tác dụng với AgNO₃ dư thu được a gam kết tủa. Hãy cho biết X có bao nhiêu đồng phân?
Câu 3. Xác định nhiệt đốt cháy tiêu chuẩn ở 25⁰C của khí methane theo phản ứng:
CH₄ + 2O₂ → CO₂ + 2H₂O. Nếu biết hiệu ứng nhiệt tạo thành tiêu chuẩn của các chất CH₄, CO₂ và H₂O lần lượt bằng: -74,85; -393,51; -285,84 (kJ/mol) (làm tròn đến hàng đơn vị).
Câu 4. Dầu gió xanh Thiên Thảo là sản phẩm của Công ty Cổ phần Đông Nam Dược Trường Sơn, dùng để chủ trị: Cảm, ho, sổ mũi, nhức đầu, say nắng, trúng gió, say tàu xe, buồn nôn, đau bụng, sưng viêm, nhức mỏi, muỗi chích, kiến cắn, tê thấp tay chân.Thành phần một chai dầu 12 mL gồm: tinh dầu bạc hà: 0,36mL, Menthol: 2,52g, Methyl salicylate: 2,16g, Eucalyptol: 0,72mL, tinh dầu Đinh hương: 0,24mL, Long não: 0,36g. Methyl salicylate điều chế theo phản ứng sau:
HOC₆H₄COOH + CH₃OH –(H₂SO₄đ, t⁰)⇌ HOC₆H₄COOCH₃ + H₂O
Để sản xuất một triệu hộp 12 chai dầu trên cần tối thiểu m tấn salicylic acid, với hiệu suất cả quá trình là 80%. Giá trị của m là (kết làm tròn đến hàng phần mười).
Câu 5. Pin nhiên liệu được nghiên cứu rộng rãi nhằm thay thế nguồn nhiên liệu hóa thạch ngày càng cạn kiệt. Trong pin nhiên liệu, dòng điện được tạo ra do phản ứng oxi hóa nhiên liệu (hydrogen, carbon monooxide, methanol, ethanol, propane,…) bằng oxygen không khí. Trong pin propane – oxygen, phản ứng tổng cộng xảy ra khi pin hoạt động như sau: C₃H₈ (khí) + 5O₂ (khí) + 6OH⁻ (dung dịch) → 3 CO₃²⁻(dung dịch) + 7H₂O (lỏng)
Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol propan theo phản ứng trên thì sinh ra một lượng năng lượng là 2500,00 kJ. Một bóng đèn công suất 10W được thắp sáng bằng pin nhiên liệu propan – oxygen. Biết hiệu suất quá trình oxi hóa propan là 80,0%; hiệu suất sử dụng năng lượng là 100%. Khi sử dụng 220 gam propan làm nhiên liệu ở điều kiện chuẩn, thì thời gian (giờ) bóng đèn được thắp sáng liên tục là (làm tròn đến số hàng đơn vị)
Câu 6. Trong số các chất sau: Ca(OH)₂, Na₂CO₃, Na₃PO₄, KCl có bao nhiêu chất có thể làm mềm nước có tính cứng tạm thời?
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các cơ sở giáo dục đại học, cao đẳng trong công tác tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên phạm vi toàn quốc, làm cơ sở để điều chỉnh nội dung và phương pháp dạy học trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định của Bộ Giáo dục và Đào tạo, thí sinh tham dự kỳ thi Tốt nghiệp THPT năm 2025 bắt buộc phải thi 3 bài: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh chọn một trong hai bài thi tổ hợp sau:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học và Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí và Giáo dục công dân (áp dụng với học sinh chương trình GDPT).
Nếu thí sinh chọn bài thi tổ hợp KHTN, thì môn Hóa học là một trong ba môn thi thành phần. Tuy nhiên, môn Hóa học không bắt buộc đối với tất cả thí sinh, mà chỉ cần thiết nếu thí sinh chọn tổ hợp KHTN để xét tốt nghiệp hoặc xét tuyển vào các trường đại học, cao đẳng yêu cầu môn này trong tổ hợp xét tuyển.
Vì vậy, “Đề thi tốt nghiệp THPT 2025 môn Hóa học – Bám sát đề minh họa – Đề 3” là tài liệu ôn tập dành cho những thí sinh chọn tổ hợp KHTN. Đề thi được thiết kế bám sát theo cấu trúc và nội dung đề minh họa của Bộ GD&ĐT, giúp học sinh rèn luyện kỹ năng làm bài, củng cố kiến thức và nâng cao sự tự tin trước kỳ thi chính thức.




