Đề thi thử đánh giá năng lực môn Hóa học 2025 – Đề số 9 là một trong những đề thi thuộc Trắc nghiệm thi thử Tốt nghiệp THPT trong chương trình Tổng hợp đề thi thử môn Hóa học THPT.
Đề số 9 được thiết kế chuẩn theo định hướng của Bộ Giáo dục và Đào tạo, là tài liệu quan trọng giúp học sinh lớp 12 luyện tập tổng hợp, phân tích sâu các dạng bài từ cơ bản đến nâng cao. Đề có độ phân hóa tốt, bao quát toàn bộ kiến thức trong chương trình, là công cụ hữu hiệu để đánh giá năng lực thực tế của học sinh trong giai đoạn nước rút ôn thi.
Các nội dung kiến thức chính trong đề thi gồm:
- Chương trình Hóa học lớp 12: Este – Lipit, Cacbohiđrat, Amin – Amino axit – Protein, Polime, Đại cương kim loại, kim loại kiềm – kiềm thổ, Nhôm, Sắt và hợp chất, điện phân, phân biệt chất, bài toán đồ thị.
- Chương trình Hóa học lớp 11: Phản ứng trao đổi ion trong dung dịch, axit – bazơ – muối, phản ứng oxi hóa – khử, các bài toán liên quan đến pH, nồng độ, độ điện li.
- Kỹ năng cần thành thạo: Giải nhanh bằng phương pháp bảo toàn, sơ đồ hóa phản ứng, tư duy phân tích dữ kiện ẩn, xử lý câu hỏi vận dụng cao trong thời gian ngắn.
Đề số 9 là tài liệu không thể thiếu trong bộ tài liệu luyện thi của học sinh 2k7, giúp củng cố toàn diện kiến thức, luyện tốc độ và nâng cao khả năng xử lý tình huống khi làm bài thi thật.
Hãy cùng Dethitracnghiem.vn tìm hiểu về đề thi này và tham gia làm kiểm tra ngay lập tức!
- Số trang: 4 trang
- Hình thức: 70% trắc nghiệm – 30% vận dụng
- Thời gian làm bài: 50 phút (không kể thời gian phát đề)
ĐỀ THI THỬ ĐÁNH GIÁ NĂNG LỰC MÔN HÓA HỌC NĂM 2025 – ĐỀ SỐ 9






PHẦN I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn 1 phương án.
Câu 1 : Kim loại có khả năng dẫn điện vì
A. chúng có cấu tạo tinh thể.
B. trong tinh thể kim loại, các electron liên kết yếu với hạt nhân, chuyển động tự do trong toàn bộ mạng tinh thể.
C. trong mạng tinh thể kim loại, các anion chuyển động tự do.
D. trong mạng tinh thể kim loại có các cation kim loại.
Câu 2 Phương pháp điều chế NaOH trong công nghiệp là
A. cho kim loại Na tác dụng với nước.
B. cho Na₂O tác dụng với nước.
C. điện phân dung dịch NaCl bão hòa có màng ngăn.
D. điện phân dung dịch NaCl bão hòa, không có màng ngăn.
Câu 3: Monomer nào dưới đây dùng để điều chế nhựa PS?
A. CH₂=CH₂.
B. CH₂=CH–Cl.
C. CH≡CH–CH₃.
D. CH₂=CH–C₆H₅.
Câu 4: Vàng (Au) tồn tại trong tự nhiên ở dạng đơn chất. Tuy nhiên, hàm lượng Au trong quặng hoặc trong đất thường rất thấp vì vậy rất khó tách Au bằng phương pháp cơ học. Trong công nghiệp, người ta tách vàng từ quặng theo sơ đồ sau:
Quặng chứa vàng (Au) →(+O₂, +KCN+H₂O) KAu(CN)₂ →(+Zn dư) Au(s)
Phương pháp điều chế kim loại nào đã được sử dụng trong quá trình sản xuất Au theo sơ đồ trên?
A. Thuỷ luyện.
B. Nhiệt luyện.
C. Điện phân.
D. Chiết.
Câu 5. Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p – p?
A. HCl.
B. H₂.
C. Cl₂.
D. CH₄.
Câu 6. Baking soda (thành phần chính là NaHCO₃) được dùng để tăng độ xốp của bánh làm từ bột là do
A. khí khuếch tán trong bột nhào (hỗn hợp bột, nước và gia vị), NaHCO₃ bị thuỷ phân tạo ra nhiều bọt khí.
B. sau khi trộn baking soda vào bột làm bánh và đun nóng, NaHCO₃ bị phân huỷ tạo sản phẩm có khí CO₂, hơi nước. Hai chất này là tác nhân tạo các lỗ trống trong bánh.
C. NaHCO₃ phản ứng với tinh bột tạo thành các lỗ trống chứa khí CO₂.
D. NaHCO₃ có enthalpy tạo thành thấp nên tự phân huỷ sinh ra CO₂, H₂O và Na₂CO₃. Cả ba chất này đều tạo các lỗ trống trong bánh.
Câu 7. Cho phương trình phản ứng hóa học của các polymer sau:
(a) [-CH₂-CH(OOCCH₃)-]n + nNaOH → [-CH₂-CH(OH)-]n + nCH₃COONa
(b) [-CH₂-CH=C(CH₃)-CH₂-]n + nHCl → [-CH₂-CH₂-CCl(CH₃)-CH₂-]n
(c) [-NH(CH₂)₅CO-]n + nH₂O → nH₂N(CH₂)₅COOH
(d) 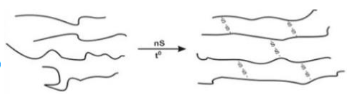
Số phản ứng hóa học giữ nguyên mạch polymer là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 8. Cho 0,015 mol một loại hợp chất oleum vào nước thu được 200 mL dung dịch X. Để trung hoà 100 mL dung dịch X cần dùng 200 mL dung dịch NaOH 0,15 M. Phần trăm của khối lượng của nguyên tố sulfur trong oleum trên là
A. 35,95%.
B. 32,65%.
C. 37,86%.
D. 23,97%.
Câu 9. Ngâm bột củ nghệ với ethanol nóng, sau đó lọc bỏ bã, lấy dung dịch đem cô để làm bay hơi bớt dung môi. Phần dung dịch còn lại sau khi cô được làm lạnh, để yên một thời gian rồi lọc lấy kết tủa curcumin màu vàng. Từ mô tả ở trên, hãy cho biết, người ta đã sử dụng các kĩ thuật tinh chế nào để lấy được curcumin từ củ nghệ?
A. Chiết và kết tinh.
B. Chưng cất và sắc kí.
C. Chiết và chưng cất.
D. Kết tinh và sắc kí.
Câu 10 . Khi xà phòng hóa triolein bằng NaOH ta thu được sản phẩm là
A. C₁₇H₃₅COOH và glycerol.
B. C₁₇H₃₃COONa và glycerol
C. C₁₅H₃₁COONa và glycerol.
D. C₁₅H₃₁COONa và ethanol.
Câu 11: Cho hình vẽ sau của amino acid X trong môi trường pH = 6 dưới tác dụng của điện trường: X có thể là
X có thể là
A. Glycine.
B. Alanine.
C. Lysine.
D. Glutamic acid.
Câu 12. X là chất rắn, vị ngọt, dễ tan trong nước. X có nhiều trong cây mía, củ cải đường …. Trong môi trường acid hoặc có enzyme làm xúc tác, X bị thủy phân thành chất Y và Z. Ở người trưởng thành, khỏe mạnh, lượng Y trong máu trước khi ăn khoảng 4,4 – 7,2 mmol/L (hay 80 – 130 mg/dL). Tên gọi của X và Y lần lượt là :
A. glucose và fructose.
B. saccharose và glucose.
C. glucose và saccharose.
D. saccharose và sorbitol.
Câu 13. Một nhà máy nhiệt điện khí có sản lượng điện 10⁶ kWh/ngày (1kWh = 3600 kJ) đã sử dụng khí thiên nhiên hóa lỏng LNG (chứa 96% CH₄, 4% C₂H₆ về thể tích) làm nhiên liệu. Các nhiên liệu bị đốt cháy hoàn toàn tạo ra sản phẩm khí (biết 64% nhiệt lượng tỏa ra của quá trình đốt cháy được chuyển hóa thành điện năng). Khối lượng khí CO₂ mà nhà máy này thải ra trong 1 ngày là m tấn (làm tròn kết quả đến hàng phần trăm). Biết nhiệt bay hơi của H₂O(l) ở 25°C và 1 bar là 44 kJ/mol; coi enthalpy của phản ứng không thay đổi theo nhiệt độ; CH₄ và C₂H₆ cháy theo các phương trình nhiệt hóa học
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(l) ΔrH⁰₂₉₈ = -893 kJ
C₂H₆(g) + 3,5O₂(g) → 2CO₂(g) + 3H₂O(l) ΔrH⁰₂₉₈ = -1560 kJ
Giá trị của m là
A. 310,15.
B. 311,39.
C. 279,88.
D. 179,12.
Câu 14 . Chất nào sau đây là thành phần chính của chất giặt rửa tổng hợp?
A. C₂H₅(OH)₃.
B. CH₃[CH₂]₁₄COONa.
C. CH₃[CH₂]₁₆COOK.
D. CH₃[CH₂]₁₁C₆H₄SO₃Na.
Câu 15. Cho từ từ dung dịch ethylamine vào ống nghiệm đựng dung dịch nitrous acid (hoặc dung dịch hỗn hợp acid HCl + NaNO₂) ở nhiệt độ thường. Khí đố thấy trong ống nghiệm
A. Có kết tủa màu trắng.
B. Có bọt khí không màu thoát ra.
C. Có kết tủa màu vàng.
D. Có khí màu nâu thoát ra.
Câu 16. Levodopa (L-dopa) là tiền chất của dopamine, thường được sử dụng như một chất thay thế dopamine để điều trị bệnh Parkinson.
Cho các phát biểu sau:
(a) L-dopa là một α-amino acid.
(b) L-dopa làm nhạt màu nước bromine.
c) Phần trăm khối lượng của nguyên tố carbon trong L-dopa là 58,42%.
(d) 1 mol L-dopa phản ứng tối đa với 3 mol H₂, có xúc tác Ni, t⁰.
(d) 1 mol L-dopa phản ứng tối đa với 3 mol KOH trong dung dịch.
Có bao nhiêu phát biểu đúng trong số các phát biểu trên?
A. 4 .
B.3.
C. 2.
D. 5.
Câu 17 . Điện phân dung dịch chất nào sau đây (dùng điện cực trơ), thu được dung dịch có khả năng làm quỳ tím chuyển sang màu đỏ?
A. NaBr.
B. NaCl.
C. CuSO₄.
D. CuCl₂.
Câu 18 . Pin quả chanh được thiếp lập gồm một dây Cu và dây Zn ghim vào một quả chanh và nối với bóng điện như hình bên. Bóng điện sáng đóng nghĩa với sự xuất hiện dòng điện. Bán phản ứng nào sau đây xảy ra ở cực dương? A. Cu²⁺(aq) + 2e → Cu(s).
A. Cu²⁺(aq) + 2e → Cu(s).
B. Zn(s) → Zn²⁺(aq) + 2e.
C. 2H⁺(aq) + 2e → H₂(g).
D. Cu(s) → Cu²⁺(aq) + 2e.
PHẦN II. Câu hỏi trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu thí sinh chọn đúng hoặc sai.
Câu 1: Điện phân dung dịch NaCl bão hòa là một phương pháp thu được những sản phẩm có tính ứng dụng rất cao trong ngành công nghiệp sản xuất.
Để điều chế chlorine với xút thì trong quá trình điện phân người ta dùng màng ngăn giữa các điện cực.
Để điều chế nước Javel thì trong quá trình điện phân người ta không dùng màng ngăn giữa các điện cực.
a) Theo thời gian, cả hai trường hợp điện phân trên nồng độ cation Na⁺ không thay đổi.
b) Trong cả hai trường hợp điện phân trên pH của dung dịch đều tăng lên.
c) Trong cả hai trường hợp điện phân trên tại anode đều xảy ra bán phản ứng khử anion Cl⁻ (aq) thành khí chlorine
d) Một loại nước Ja vel có khối lượng riêng 1,15 g/ml được bán trên thị trường với dung tích là 1,0 lít có nồng độ % NaClO và NaCl lần lượt là: 12,96% và 15,26%. Nồng độ % của dung dịch NaCl trước khi điện phân là 25,3%. (Coi khí sinh ra không tan trong nước và hiệu suất phản ứng đạt 100%). Làm tròn kết quả đến hàng phần mười
Câu 2: “Glucose là một monosaccharide phổ biến trong đời sống. Glucose tồn tại ở hai dạng mạch hở và mạch vòng, trong dung dịch glucose chủ yếu tồn tại ở dạng mạch vòng như sau: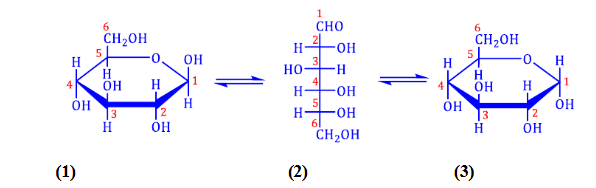 a) Các dạng công thức cấu tạo (1), (2) và (3) của glucose lần lượt là α-glucose, glucose mạch hở và β-glucose.
a) Các dạng công thức cấu tạo (1), (2) và (3) của glucose lần lượt là α-glucose, glucose mạch hở và β-glucose.
b) Ở dạng mạch vòng, glucose thường gặp ở các dạng vòng 5 cạnh là α-glucose và β-glucose.
c) Dung dịch glucose có thể tham gia phản ứng với copper (II) hydroxide và phản ứng với thuốc thử Tollens.
d) Ở dạng mạch vòng, nhóm –OH ở vị trí carbon số 2 được gọi là nhóm –OH hemiacetal có khả năng phản ứng với methanol khi có mặt xúc tác HCl khan tạo thành methyl glycoside.
Câu 3: Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: CH₃COOH, C₂H₅OH, C₄H₁₀, CH₃CH(OH)CH₃ và giá trị nhiệt độ sôi được ghi trong bảng sau: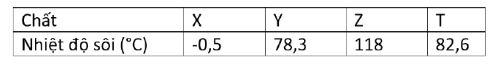 Cho các phát biểu:
Cho các phát biểu:
a) X là C₄H₁₀, Z là CH₃COOH, Y là CH₃CH(OH)CH₃.
b) Từ X, Y có thể điều chế trực tiếp ra Z.
c) Oxi hóa không hoàn toàn Y, T bằng CuO (t⁰) thu được sản phẩm hữu cơ lần lượt P và Q. Có thể phân biệt P, Q bằng phản ứng iodoform.
d) Oxi hóa hoàn toàn 26,1 gam X với xúc tác thích hợp (hiệu suất 80%) thu được 864 gam dung dịch Z nồng độ 5%.
Câu 4: Cho các phát biểu sau đây về dạng hình học của phức chất:
a) Phức chất mà xung quanh nguyên tử trung tâm có 4 liên kết σ thường có dạng hình học là tứ diện hoặc phức chất vuông phẳng và được gọi là phức chất tứ diện hoặc phức chất vuông phẳng.
b) Phức chất mà xung quanh nguyên tử trung tâm có 6 liên kết σ có dạng hình học là bát diện và được gọi là phức chất bát diện.
c) Phức chất của platinum như cisplatin, carboplatin là hoạt động quang trọng trong một số loại thuốc chữa bệnh ung thư.
d) Khi hòa tan CuSO₄ và nước tạo thành phức chất aqua [Cu(H₂O)₆]²⁺ có màu xanh. Khi nhỏ thêm vài giọt dung dịch kiềm sẽ tạo kết tủa xanh nhạt Cu(OH)₂. Khi cho đến dư dung dịch ammonia vào kết tủa, kết tủa tan, tạo thành dung dịch màu xanh lam chứa ion phức [Cu(NH₃)₄(H₂O)₂]²⁺, thường viết là [Cu(NH₃)₄]²⁺.
PHẦN III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.
Câu 1: Muối Epsom (MgSO₄.nH₂O) có nhiều ứng dụng: vừa có thể dùng pha chế thuốc nhuận tràng, vừa như một loại phân bón cho cây, hay dụng dịch khử khuẩn. Khi làm lạnh 440,0 gam dung dịch MgSO₄ 27,27% thì có 49,2 gam muối Epsom tách ra, phần dung dịch thu được có nồng độ 24,56%. Biết độ tan của MgSO₄ tại 80°C và 20°C lần lượt là 54,80 gam và 35,10 gam. Khối lượng Epsom được tách ra khi làm lạnh 9288 gam dung dịch bão hoà MgSO₄ từ 80°C xuống 20°C là b gam.
Giá trị của b gam bằng (kết quả làm tròn đến hàng đơn vị).
Câu 2 . Tiến hành thí nghiệm theo các bước sau:
– Bước 1: Chuẩn bị hai ống nghiệm có đánh số (1) và (2); thêm vào mỗi ống nghiệm khoảng 0,5 – 1 mL dung dịch CuSO₄ 5% và 1 mL dung dịch NaOH 10%, lắc nhẹ.
– Bước 2: Cho 3 mL dung dịch glucose 2% vào mỗi ống nghiệm, lắc nhẹ.
– Bước 3: Đun nhẹ ống (2) đến khi hoá chất trong ống nghiệm đổi màu hoàn toàn.
Cho biết những phát biểu sau đây
a) Ở bước 2 thu được dung dịch màu xanh lam thẫm chứng minh glucose có tính chất của aldehyde.
b) Nếu thay glucose bằng fructose hoặc saccharose, hiện tượng thu được ở các bước 2 và bước 3 không thay đổi.
c) Ở bước 3, kết tủa đỏ gạch thu được trong ống (2).
d) Ở bước 1, cần dùng dư dung dịch NaOH.
Số phát biểu đúng là
Câu 3: Cho một số tính chất: có dạng sợi (1); tan trong nước (2); dùng để sản xuất tơ nhân tạo (3); phản ứng với nitric acid đặc (xúc tác sulfuric acid đặc) (4); tham gia phản ứng với thuốc thử Tollens (5); bị thuỷ phân trong dung dịch acid đun nóng (6). Tính chất nào đúng với cellulose? (Liệt kê theo số thứ tự tăng dần)
Câu 4: Cho các chất: dung dịch lòng trắng trứng (1), ethylamine (2), Val-Gly-Ala (3), Gly-Ala (4), amilose (5), anilin (6), aldehyde acetic (7). Có bao nhiêu chất hòa tan được Cu(OH)₂ trong môi trường kiềm ở nhiệt độ thường?
Câu 5: Phản ứng phân huỷ hydrogen iodide được thể hiện theo sơ đồ năng lượng sau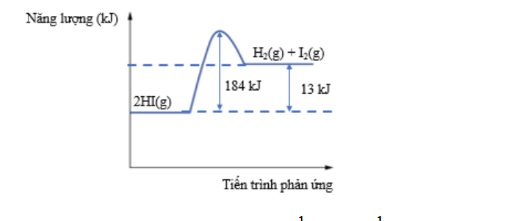
Tính biến thiên enthalpy của phản ứng \( \dfrac{1}{2}H_2(g) + \dfrac{1}{2}I_2(g) \longrightarrow HI(g) \)
Câu 6: Để sản xuất được Bạc (Ag) tinh khiết, cần tiến hành các bước sau:
Bước 1: Nghiền nhỏ 50 kg quặng bạc sunfua (chứa 73,25% Ag₂S) rồi cho tác dụng vừa đủ với dung dịch natri xianua (NaCN). Sau khi lọc, thu được dung dịch muối phức bạc: Ag₂S + 4NaCN → 2Na[Ag(CN)₂] + Na₂S.
Bước 2: Cho kim loại Zn tác dụng với dung dịch muối phức bạc: Zn + 2Na[Ag(CN)₂] → Na₂[Zn(CN)₄] + 2Ag.
Biết hiệu suất các phản ứng trên đều đạt 92%. Khối lượng Bạc (Ag) thu được sau phản ứng là bao nhiêu kg? (kết quả làm tròn đến hàng đơn vị)
Mục đích tổ chức kỳ thi Tốt nghiệp THPT năm 2025 là gì?
Căn cứ theo các văn bản chỉ đạo và hướng dẫn của Bộ Giáo dục và Đào tạo, kỳ thi Tốt nghiệp THPT năm 2025 được tổ chức nhằm các mục đích chính sau:
– Đánh giá kết quả học tập của học sinh sau 12 năm học theo chương trình giáo dục phổ thông mới.
– Lấy kết quả thi để xét công nhận tốt nghiệp trung học phổ thông và làm căn cứ cho các cơ sở giáo dục đại học, cao đẳng tuyển sinh.
– Góp phần đánh giá chất lượng giáo dục tại các địa phương và trên phạm vi toàn quốc, từ đó làm cơ sở điều chỉnh nội dung, phương pháp giảng dạy trong các nhà trường.
Thí sinh thi tốt nghiệp THPT năm 2025 có bắt buộc phải thi môn Hóa học không?
Theo quy định hiện hành của Bộ Giáo dục và Đào tạo, thí sinh dự thi Tốt nghiệp THPT năm 2025 phải tham gia 3 bài thi bắt buộc: Toán, Ngữ văn và Ngoại ngữ.
Ngoài ra, thí sinh lựa chọn một trong hai bài thi tổ hợp:
– Tổ hợp Khoa học Tự nhiên (KHTN): gồm các môn Vật lí, Hóa học, Sinh học.
– Tổ hợp Khoa học Xã hội (KHXH): gồm các môn Lịch sử, Địa lí, Giáo dục công dân (đối với học sinh chương trình GDPT).
Trong bài thi tổ hợp KHTN, Hóa học là một trong ba môn thành phần. Thí sinh không bắt buộc phải thi môn Hóa học nếu không chọn bài thi KHTN. Tuy nhiên, nếu thí sinh chọn bài thi KHTN để xét tốt nghiệp hoặc để xét tuyển vào các ngành đại học, cao đẳng có yêu cầu môn Hóa học thì bắt buộc phải tham gia thi môn này.
Do đó, Đề thi minh họa tốt nghiệp THPT 2025 môn Hóa học – Đề số 9 là tài liệu tham khảo hữu ích, giúp thí sinh luyện tập, đánh giá năng lực hiện tại và nâng cao kỹ năng làm bài, chuẩn bị tốt nhất cho kỳ thi chính thức sắp tới.




